欢迎您注册蒲公英
您需要 登录 才可以下载或查看,没有帐号?立即注册
x
食药总局:这33个进口药将被查!行业动态
来源:赛柏蓝 时间:2017-12-27  评论: 2  阅读: 253
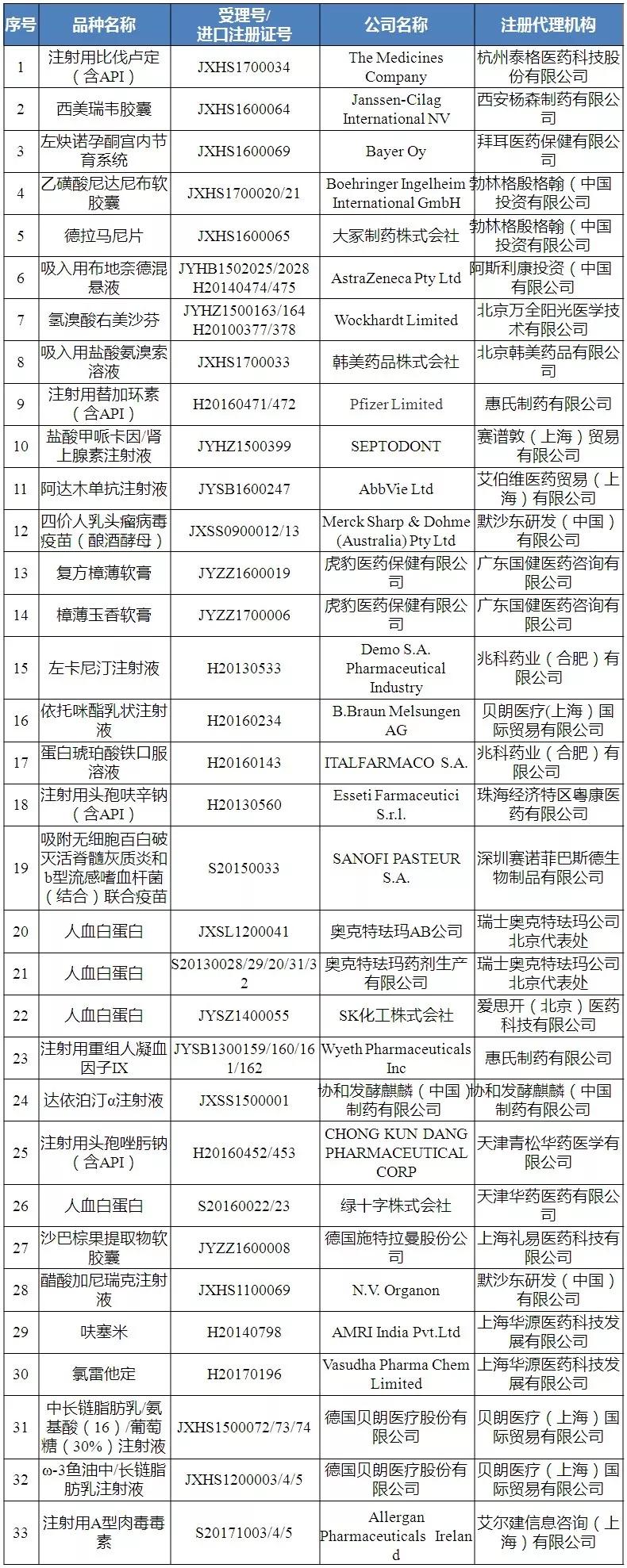
12月25日,国家食药监总局食品药品审核查验中心发布《关于启动2018年药品境外生产现场检查有关事宜的通知》,通知要求,33个品种被纳入为2018年度进口药品境外生产现场检查。

中心拟于2018年1月4日(暂定)在北京召开药品境外检查工作企业通气会,将就境外检查任务及检查要求进行通报。相关品种的国内代理机构在12月30日前按要求发送资料至邮箱pai@cfdi.org.cn。
2018年进口药品境外生产现场检查任务公告
严查进口药
从新版GMP认证,药品生产飞行检查,再到生产工艺自查,药监部门对药品生产领域的监管越发严厉。在各种严查中,不仅国内药企在其中频频碰壁,外资药企也难免中招。
实际上,早在2011年,我国就已着手开展对外资药企的监管。首次开展进口药品境外生产现场检查,7个检查组分别赴美、法、意、印、匈、韩、日等国就7个品种药品进行调研。
而到2016年,进行境外生产现场核查的品种数已升至49个,其中有4家进口企业生产的4个品种存在违反《中华人民共和国药品管理法》及相关规定的行为,被停止进口通关备案。
业内人士表示,随着药品质量监管越来越严格,不仅是国内企业,外资药企也将成为严查的重点。部分抱有侥幸心理,对进口到中国的药品未按照法规进行合理的质量管理,也不积极履行生产和检验发生重大变更应进行补充申请的义务的外资药企,也难逃严惩。
今年6个进口药被禁
2017年共有39个品种被列入进口药品境外生产现场检查任务,截止目前为止,已有6个进口药栽在生产现场检查上。可见检查力度之大,要求之严。
具体情况如下:
11月8日,总局发布《关于暂停销售使用印度EnalDrugsPvt.Ltd.雷贝拉唑钠原料药的公告(2017年第133号)》,印度EnalDrugsPvt.Ltd.生产的雷贝拉唑钠原料药被禁。
10月31日,总局发布《关于暂停销售使用德国B.BraunMelsungenAG中长链脂肪乳/氨基酸(16)/葡萄糖(16%)注射液及ω-3鱼油中/长链脂肪乳注射液的公告(2017年第127号)》,两个产品,各有3个规格被禁。
10月24日,总局发布《关于暂停销售使用阿根廷TRBPharmaS.A.单唾酸四己糖神经节苷脂钠盐注射液的公告(2017年第123号)》,阿根体的神经节苷脂(施捷因)被禁
6月2日,总局发布《关于暂停销售使用单唾液酸四己糖神经节苷脂钠注射液的公告(2017年第69号)》,巴西的一个神经节苷脂(重塑杰)被禁。
3月20日,总局发布《关于停止进口瑞士OMPharmaSA细菌溶解产物胶囊的公告(2017年第30号)》,瑞士OMPharmaSA的细菌溶解物胶囊(泛福舒)被禁。
过去很长时间里,药监部门把监督和检查的工作重点放在国内,外资药企在生产、研发、招标等方面一直享有超国民待遇。随着国内药企的不断发展壮大,要求实施一视同仁的监管政策的呼声越来越高。
今年1月25日,在国务院新闻办新闻发布厅举行吹风会上,国家食药监总局副局长吴浈表示,开展境外现场检查是我国药品监管迈向国际化的一个重要步骤,实现了中国药品监管关口的前移。
今后,食品药品监管总局还将进一步加强境外检查工作,严格把关进口药品质量,督促进口药品生产企业持续合规,遵守我国药品管理的有关规定,保障进口药品的质量和安全。
|  |手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033
|手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033