欢迎您注册蒲公英
您需要 登录 才可以下载或查看,没有帐号?立即注册
x
本帖最后由 毒手药王 于 2018-6-8 20:29 编辑
药物晶型是这几年国内做仿制药的一个热门方向,尤其是仿制药的一致性评价工作开展过后,对晶型的研究更是如火如荼,各仿制药厂都开始着手研究原研的晶型,力图使自己的产品与原研的在晶型上保持一致,从而减少在一致性评价上的弯路。
晶型最头疼的无非就是:1、不一致到什么程度,是完全另一个晶型,还是混晶,这可能就得定量了,至少半定量; 2、晶型变了,对溶解度有无影响?对溶出有无影响,是何种影响?对稳定性有无影响,是何种影响?对粒径、比表面积有无影响,粒径影响了之后会不会影响工艺,是何种影响?如有影响,如何通过调整处方工艺消除这些影响,达到和原研质量一致?这里面需要研究和说明的内容可就比较多啦; 3、从技术上看,说明“晶型不一致”和“晶型一致”难度上是没有什么区别的,都是需要挑战制剂中晶型鉴定这个课题的,都是需要对晶型有深入的研究的。
首先谈下各国药典中对晶型的一些要求
在USP、EP、中国药典中,晶型的确认和测定方法基本一致,包括了绝对测定法X单晶衍射,以及相对测定法X粉末衍射、红外、DSC、TG、熔点、拉曼等。在中国药典中,以上检测项目各有归属。红外、X粉末衍射归属在鉴别中,熔点归属在性状中。在USP、EP中的鉴别项目中也有红外的检测,但描述与中国药典不一样。
1、红外,随便找到一个品种。
中国药典中红外鉴别这样描述:本品的红外光吸收图谱应与对照的图谱(光谱集###图)一致 。
USP和EP中红外鉴别这样描述:如果样品与对照品在固态获得的光谱显示出差异,则将要检查的物质和参考物质分别溶解在异丙醇(品种不一样,溶剂也不一样,这里随便举个例子)中,蒸发至干燥并使用残余物记录新的光谱。
对于多晶型药物,中国药典的描述将是一个不可逾越的坎,某些多晶型药物的红外是存在差异的,中国药典中的检测方法实际已经规定了你只能做出与对照品一致的晶型才能是合格的产品,而USP与EP则不是,将样品与对照品在相同的溶剂中重新溶解、蒸发干燥即排除了晶型的影响。再说鉴别的目的其实是为了鉴别物质的真伪,是否需要晶型一致呢?如果该原料药是用于注射剂或输液的制备,对晶型没有要求,这样的标准是否是多此一举呢?况且,提供给中检所制备红外光谱集的对照品的晶型是否又与原研的晶型一致呢?如果不一致,那是不是企业要先做出与药典规定一致的晶型,再做出符合制剂需求的晶型来进行制剂?
2、熔点
中国药典中对很多原料药都进行了熔点检测,但USP和EP中几乎不检测熔点,熔点在USP、EP中是作为晶型的检测手段之一,但在中国药典中却变成了性状,这对于某些多晶型药物又是当头一棒,有可能自己根本不需要这个晶型,却还为了符合标准不得不做这个晶型以符合其熔点。
3、X衍射
2015版药典中有部分药物增加了X粉末衍射的检测,同样归属在鉴别里面。X粉末衍射同样是晶型的检测手段之一,属于相对测定法应与对照品进行对比。而我所接触的两个产品来看,都是多晶型药物,药典的规定却不是与对照品进行比较,只是不痛不痒的规定了几个2θ角,任一个晶型的X衍射均符合药典的规定。已经有了HPLC、紫外和红外的鉴别,又何必进行一个毫无区分力的X衍射。
在FDA——仿制药晶型研究的技术指导原则中有这样一段话:
原料药的不同多晶型是因其内部固态结构不同,并非化学结构不同。在 1992 年法规终稿序言部分涉及活性成分一致性时, FDA 否决了一个提议,该提议建议要求简略申请的申请者证明仿制药中的活性成分和原研药中的活性成分“具有相同的物理和化学性质,没有因使用不同的生产或合成工艺导致额外的残留或杂质,并且立体化学特征和固体形态没被改变”。所以依照法规的含义,在批准简略申请时,原料药多晶型上的不同并不代表活性成分的不同。
晶型作为原料药的物理性质不应作为鉴别应检测的项目,因为鉴别是确定药物的真伪。2015版中国药典,在制定标准时,未能很好的考虑到这一点,导致鉴别与晶型测定混淆。
在一致性评价的路上,我们一定要擦亮眼睛,避开那些混淆、扰乱我们前进方向的障碍,只有多看,多学,多比较才能找到正确的路。
下面再谈谈晶型与一致性评价的关系
国外对仿制药晶型的要求并没有那么严苛,因为晶型只是作为原料药的一部分物理性质,不同的晶型可能对溶解性、溶解度、生物利用度(BA)和生物等效性(BE)有一定的影响,也会对药物制剂生产有一定影响,还会对药物的稳定性有一定影响,多晶型的研究是仿制药研究中不可或缺的一个部分,其目的是为仿制药的制剂研究服务,并不要求仿制药的晶型必须与原研一致。
在FDA——仿制药晶型研究的技术指导原则中还有这样一段话:
除了符合一致性的标准外,每个简略申请的申请者需证明药物制剂足够稳定,并且和原研药生物等效。虽然多晶型上的差异会影响药物的稳定性和生物等效性,但是这些特性还与剂型配方、生产工艺以及原料药和辅料的其他理化特性(例如:粒子大小,吸湿性)有关。使用一个多晶型与原研药不同的原料药不一定会妨碍简略申请的申请者开发出生物等效并且稳定的仿制药,仿制药中的原料药不需要与原研药中原料药的多晶型相同。 多年来,FDA 批准了大量的简略申请,其中不乏与对应的原研药多晶型不同的仿制药(例如:华法林、法莫替丁和雷尼替丁)。其间, FDA 也批准了一些简略申请,其中仿制药所用原料药固体的溶剂化或水合状态与对应的原研药的不同(如:盐酸特拉唑嗪、氨苄西林和头孢羟氨苄)。
可见,国外更关注的是制剂后的生物等效性,殊途同归,条条大路通罗马。
诚然,晶型与原研一致也是制剂后溶出一致的一个保证,但原研的晶型究竟是什么,我想这也是很多做一致性评价的企业最头痛的问题,参比制剂的取得已经够难,更别说原研原料药,更多的信息是来自于原研的专利,但人家核心的东西又岂能轻易公之于众。最近,国内也有些研发单位号称可以从参比制剂中检测出原研的晶型。我们找了一家国内比较有名的研发单位合作,结果不甚理想,得出的结论实在不敢苟同,因为我们的产品在研磨、压力、粉碎的条件下会转晶,我们自己的制剂产品在其检测报告中竟然是纯的亚稳态晶型,而我们提供给制剂的原料药都不是纯的亚稳态晶型。其实,我们的制剂已与参比制剂的溶出一致,原研的专利也并未说明必须是纯的亚稳态晶型用于制剂,但领导这样要求,我们下面也没有办法,一切静待BE的结果吧。
最后说说晶型标准制定的问题
2015版中国药典9015药品晶型研究及晶型质量控制指导原则中也提出了“优势晶型”的说法(详见2015版中国药典四部)。而各路专家也现身说法,提出了“无效晶型”的说法,即是某些多晶型药物中的某一晶型无疗效或疗效很低。我个人看法是“无效晶型”这根本就是一伪学术,多晶型药物可能在溶解性上有一定差异,但溶解后已无晶型的区分,活性成分完全一样,药物需要溶解才能吸收,可能体现的就是某些晶型的溶解速度较慢,导致药效缓慢。但对于难溶性药物来说,虽然晶型会影响制剂后的溶出,但粒度、制剂的工艺是影响制剂后溶出的更为关键因素。
是否有必要为为自己的产品建立一个晶型标准,我个人的看法是一定要慎重,否则会搬起石头砸了自己的脚,FDA——仿制药晶型研究的技术指导原则中对晶型标准制定也是非常慎重的态度,首选以制剂溶出符合要求来制定原料药的晶型标准,如果制剂溶出不能体现才会以其他固态特征法(如红外、X衍射、熔点、DSC等)来确定原料的晶型标准。
在制定原料药的标准时,一定要充分调查、分析,不要轻易的将熔点、DSC、X衍射等项目草率的订入质量标准 。若药典已收载并规定了熔点、红外等检测项目且与制剂所用晶型发生冲突时,建议参考FDA——仿制药晶型研究的技术指导原则进行充分的研究说明。
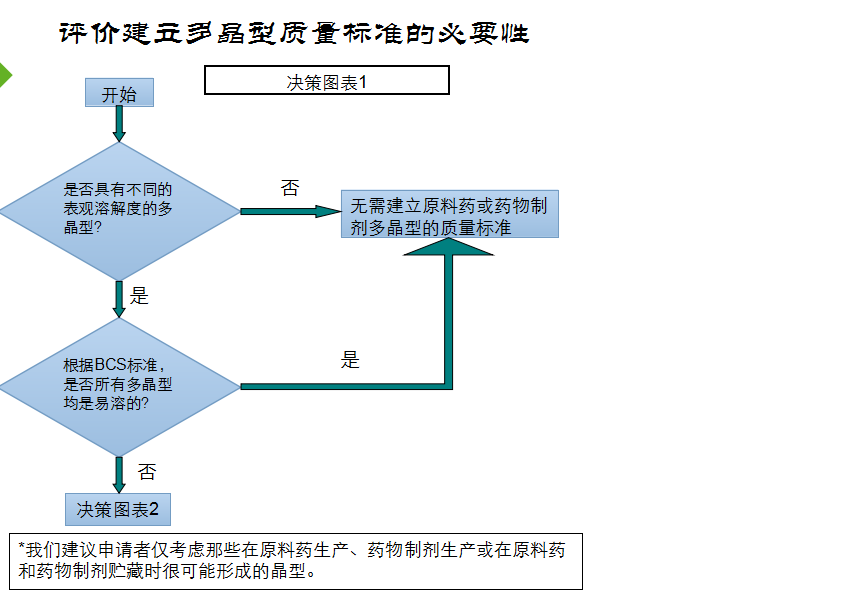
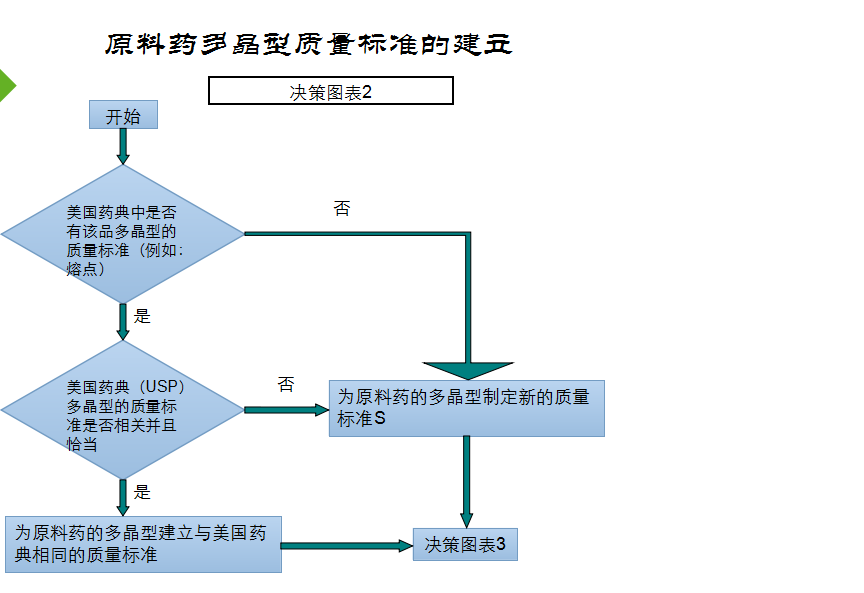
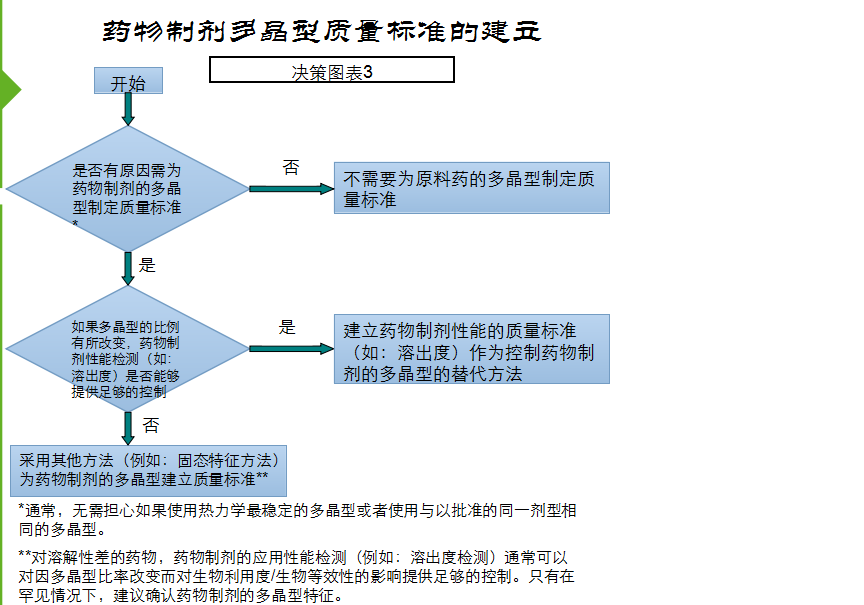
汇总一下:
一、原料药晶型研究
1. PXRD法测定原料药的晶型,并与原研进行对比。如果有多批次的原料药,建议每一批都测一下晶型。
2. PXRD法测定自制制剂中原料药的晶型(3批中试及以上样品,至少),并与原研制剂对比。
3. 自研制剂中的晶型应与原研一致。如晶型不一致,则通过实验数据证明对质量和疗效无影响。
二、原料药粒径研究
1. 激光粒度法测定原料药的粒径,如果有多批次的原料药,建议每一批都测一下粒径。
2. 通过过筛、粉碎等方法得到不同粒径的原料药,激光粒度法测定其不同粒径。然后制成制剂,考察不同粒径对溶出曲线的影响。
3. 在上述研究的基础上,得出可接受的粒径分布范围。
4. 测定中试批、申报批的每批原料药的粒径,确认其符合要求。
5. 如果制剂生产时有原料药的粉碎、过筛等工序,需测定处理后的原料药粒径,并确定可接受的粉碎、过筛工艺参数。
6. 如有条件,采用扫描电镜法考察原研制剂与自制制剂中原料药的粒径是否一致。
查询药物晶型分为以下几步:
(1)下载药品说明书,确定原研药所用盐型、水合物形式或溶剂合物形式。下载药品说明书有两种方法,第1种方法是直接进www.英文商品名.com,找到Full Prescribing Information点击下载;第2中方法是进FDA的Drug Information (Drugs@FDA)搜索,然后进Label Information下载Label (PDF) 。药品说明书的第11项是对原料药的描述,可以确定原研药所使用的盐型、水合物形式或溶剂合物形式。
(2)查找原研药直接相关的专利。我们可以有这样一个假设,如果原料药有多晶型且非常重要,原研厂家一定会申请专利,构建化合物专利之后的另一道防线。查询晶型专利最简单的方法是用谷歌搜索关键词,但很多情况不一定能查到,这时需要进FDA的Orange Book Search查看原研药专利。我个人更喜欢进Drug Future的美国FDA药品数据库搜索,因为网速不好的情况下FDA会很卡。
(3)通过化合物专利找晶型专利。Orange Book给出的是原研药几个直接相关的专利,一般申请时间最早的就是化合物专利,如果运气好这时就找到了晶型专利。很多情况Orange Book是不收录晶型专利的,这时需要查看化合物专利的被引专利,因为晶型专利很可能会引用到化合物专利。我一般用谷歌搜索,查看US专利,底部就有“被以下专利引用”的表格,优先关注原研厂家的,这时一般就能找到晶型专利,或者覆盖晶型的工艺专利。
(4)原研药晶型的确定。原研厂家晶型专利里往往有多个晶型,这时需要仔细阅读专利,同时利用第1步得到的信息推断。例如米诺膦酸晶型专利US5480875中提到A、B、C晶型都不能用,D晶型做到了公斤级,E晶型只做了克级,原研用D晶型的可能性比较大。再如阿哌沙班晶型专利保护了H2-2 (溶剂合物)、N-1、二水合物三种晶型,而药品说明书中的描述是不含水或溶剂,因此可推断原研药晶型为N-1。
这里分享的只是一种简单的药物晶型查询方法,如果没有找到有效信息,就需要进行全面的专利调研和技术研究了。每个仿制药立项前都应当花几天时间调研专利,逐条分析各项权利要求、技术要点,这是避免侵权的第一步,也是主动挑战专利的第一步。晶型专利的效力比化合物专利弱得多,一般很难限制住经验丰富的仿制药厂家,但确实也能将不少仿制药厂挡在门外。
|  |手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033
|手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033