欢迎您注册蒲公英
您需要 登录 才可以下载或查看,没有帐号?立即注册
x
阿尔茨海默症 (AD) 属于老年痴呆症的一种,是一种常见的神经退行性疾病,其机制主要涉及 β-淀粉样蛋白斑块 (Amyloid-β, Aβ) 等。本期小 M 给大家介绍几种针对 Aβ 的生物检测方法!
Section.01
Aβ 的常见生物检测方法
针对 Aβ 检测的生物实验方法有多种,从 ELISA 和 Western Blot 的精准定量,到质谱分析的高分辨率检测,再到 IHC 的组织分布观察,这些技术揭示关键蛋白 Aβ 的奥秘,助力 AD 研究!
Section.02
酶联免疫吸附测定
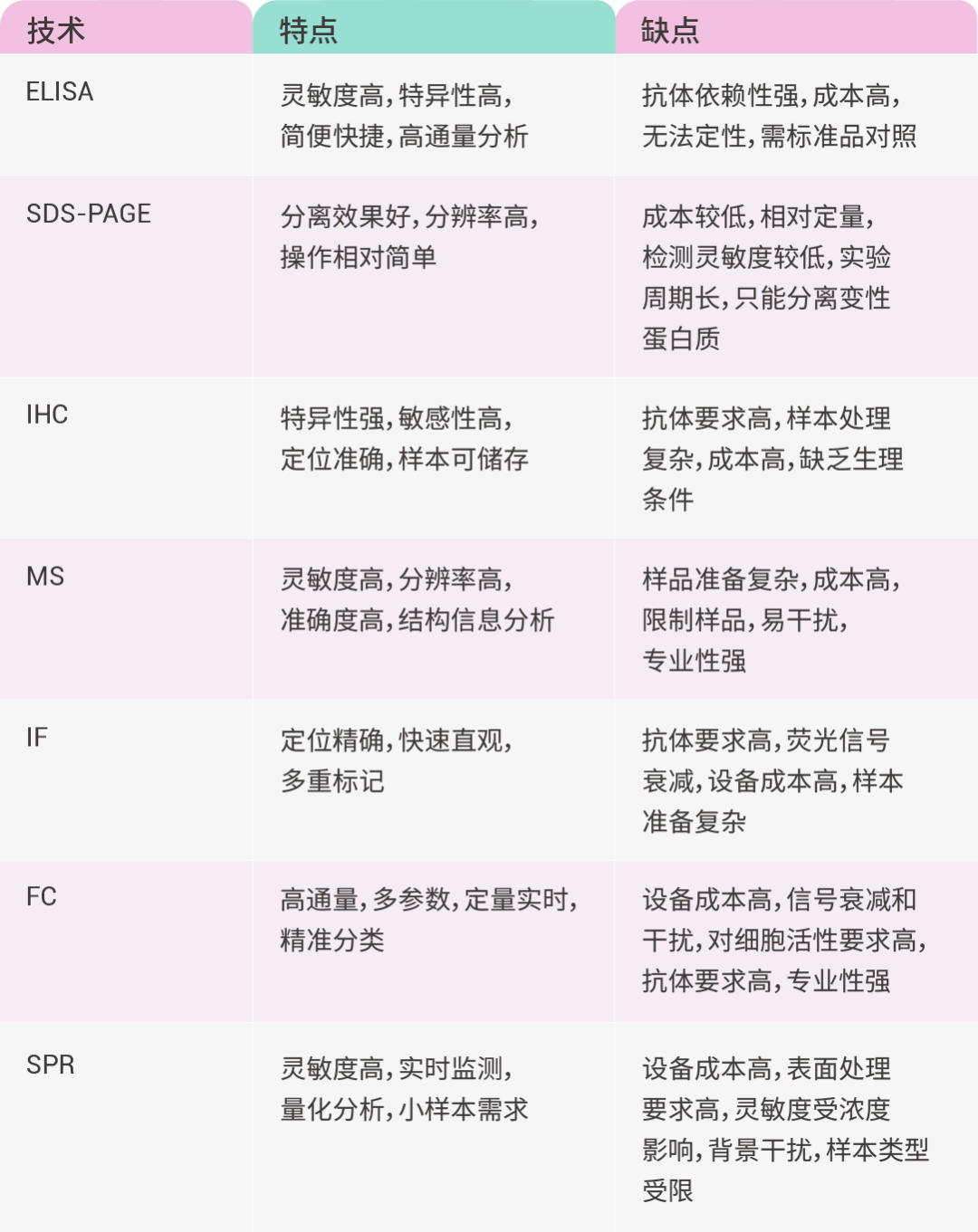
研究表明,AD 患者脑脊液 (CSF) 的 Aβ42 水平的变化一般发生在临床症状出现前 10-20 年,而血液中与 AD 相关的生物标志物丰度非常低,因此需要超灵敏的检测技术来量化 Aβ42 水平。通过 酶联免疫吸附测定 (ELISA) 和其他常规免疫测定法测定显示,AD 患者 CSF 中的 Aβ42 浓度降低,这可能与大脑中的血脑屏障和清除系统有关。而利用免疫磁还原 (IMR) 技术检测显示 AD 早期患者血液 Aβ42 水平升高,特别是 AD 引起的轻度认知障碍 (图 1)[1]。
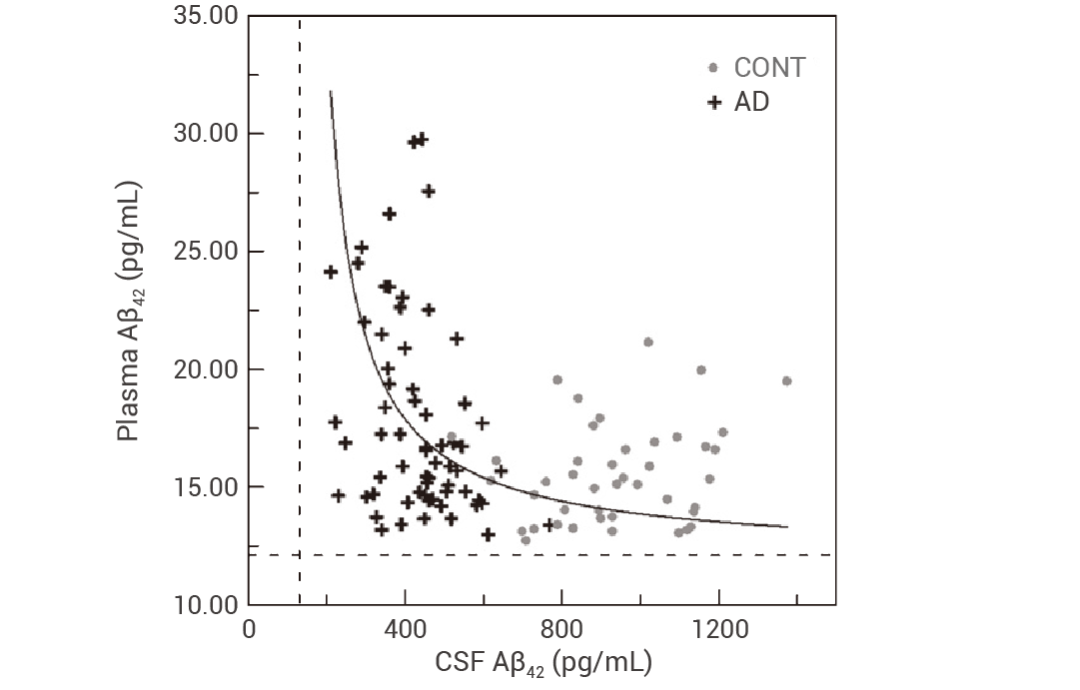
图 1. 对照组 (CONT) 和 AD 组血浆 Aβ42 和 CSF Aβ42 水平呈负相关[1]。
01小贴士ELISA 基本原理:将一定浓度的抗原或抗体通过物理吸附的方法固定于聚苯乙烯微孔板表面,加入待测样本,通过酶标物显色的深浅间接反映被测抗原或者抗体是否存在或量的多少。
IMR 基本原理:利用分散在水中之披覆有抗原或抗体的磁性粒子与待测生物分子结合后,形成磁性粒子丛集或造成磁性粒子变大变重,再量测因这些磁性粒子丛集或大磁性粒子的形成而改变试剂磁性大小,从而检测出待测生物分子浓度的新颖检测方式。
Section.03
SDS-聚丙烯酰胺凝胶电泳
Aβ 寡聚体是在 Aβ 聚集过程中早期的致病分子形式和神经毒性物质。由于 Aβ 寡聚体异质且瞬时存在,光诱导未修饰蛋白质交联 (PICUP) 反应可有效的交联得到 Aβ40/Aβ42 寡聚物,再通过 SDS-聚丙烯酰胺凝胶电泳 (SDS-PAGE) 量化其相对丰度。Aβ40 主要通过二聚体至四聚体进行寡聚化,而 Aβ42 主要通过五聚体和六聚体进行寡聚化[2][3],且随着寡聚体增加而表现出强度降低 (图 2a)。鉴于 SDS 影响 Aβ 的寡聚化状态,电喷雾电离质谱法 (ESI-IM-MS) 进一步准确表征低丰度 Aβ 寡聚体的分布 (图 2b)[4]。
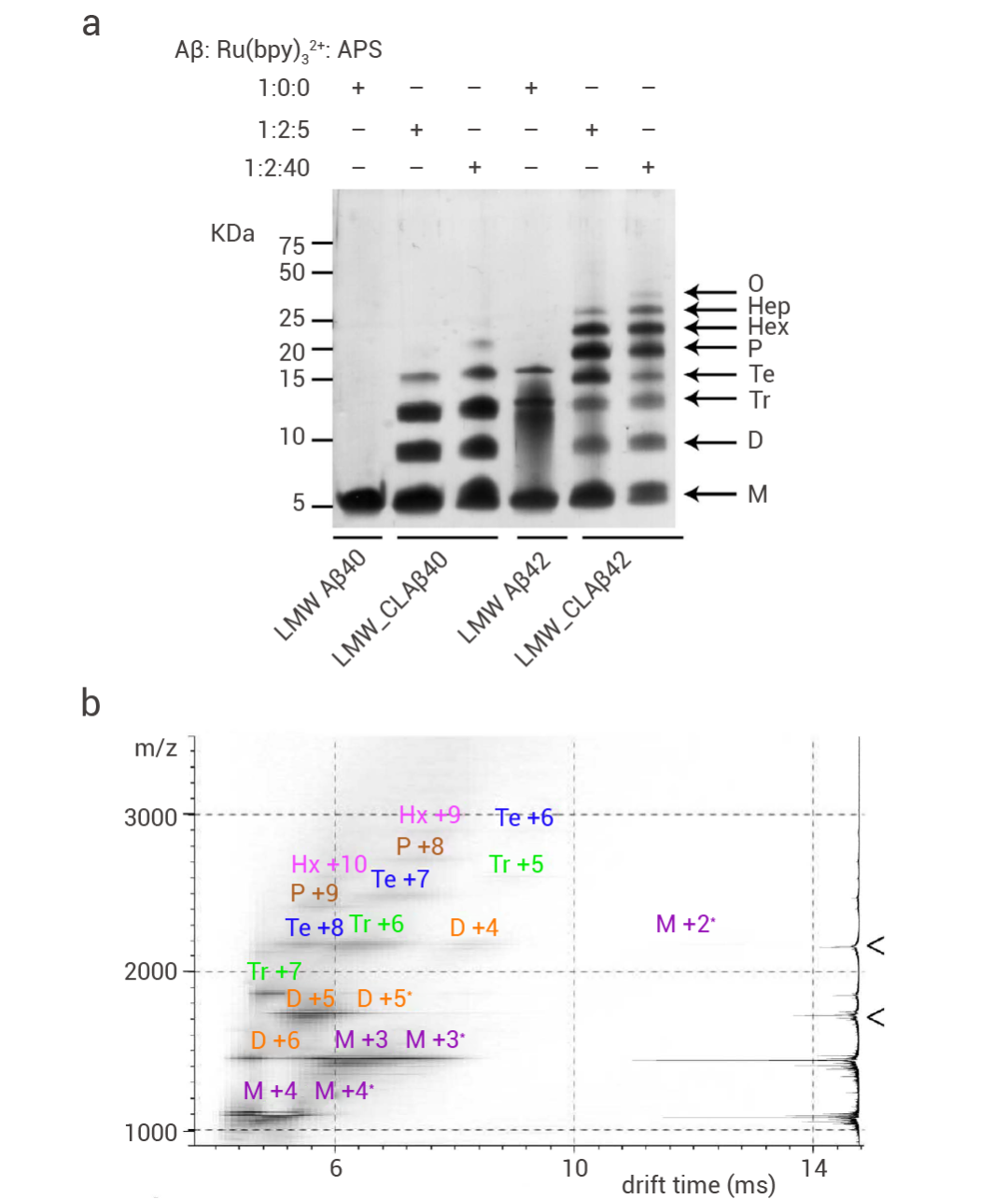
图 2. Aβ42 主要通过五聚体和六聚体进行寡聚化[4]。
a. 通过 SDS-PAGE 分析表征 LMW 和 LMW_CL Aβ40 和 Aβ42 低聚物分布。b. LMW Aβ42 的 ESI-IM-MS 谱图 。(M = 单体,D = 二聚体,Tr = 三聚体,Te = 四聚体,P = 五聚体,Hex/Hx = 六聚体。)
02小贴士PICUP基本原理:利用光能作为催化剂,驱动特定的化学反应,从而在无需修饰蛋白质的情况下实现交联。
SDS-PAGE基本原理:在 SDS-PAGE 中,加入十二烷基硫酸钠(SDS)和强还原剂,SDS 破坏蛋白质的氢键和疏水相互作用,使其构象改变,而还原剂打开蛋白质内的二硫键,使其分解为亚基。根据待测样品中蛋白质分子量大小的不同,使其在电泳胶中分离。
ESI-IM-MS基本原理:在毛细管的出口处施加高电压,产生的高电场将从毛细管流出的液体雾化成微小的带电液滴。随着溶剂的蒸发,液滴表面的电荷强度逐渐增加,最后液滴分裂成一个或多个带电离子,从而使分析物以单电荷或多电荷的形式进入气相变成气相离子,再检测产生高电荷离子的质量电荷比。
Section.04
免疫组化
AD 的主要特征是老年斑 (SP) 和 神经原纤维缠结 (NFT) 在脆弱的大脑区域沉积。SP 在神经元内积累,由聚集的 Aβ40/42 肽组成。用 Aβ42 的 C 端特异性抗体对认知障碍受试者中的脑组织染色,可以清晰的看到 AD 患者早期脑部组织显示出大量的区域特异性神经元内免疫反应性,尤其在海马/内嗅皮层等区域的锥体神经元中 (图 3)[5]。
图 3. Aβ42 在 AD 患者早期脑部组织中积累[5]。
a. 神经学正常的 3 岁患者(对照)海马体 CA4 区域的 Aβ42 染色;只能看到微弱的神经元染色。b. 一名患有唐氏综合征的 3 岁儿童的明显 CA4 Aβ42 免疫反应性。c. 79 岁无痴呆患者的 Aβ42 染色 表明内嗅皮层的 II 层神经元(箭头)有明显的 Aβ42 细胞内染色。d. 83 岁的认知障碍受试者中,在 Aβ42 (RU) 染色的神经元中明显缺乏核内 Aβ42 染色; e. 72 岁的晚期 AD 受试者的“神经元”形状的老年斑 (SP)(箭头)与更传统的球形 SP 相邻;f. 79 岁认知障碍受试者的 CA1 区域显示神经元内 Aβ42 免疫反应性和明显的神经元外弥漫性斑块样染色 (箭头)。
03小贴士IHC 基本原理:融合免疫学原理 (抗原抗体特异性结合) 和组织学技术 (组织的取材、固定、包埋、切片、脱蜡、水化等),通过化学反应使标记抗体的显色剂 (荧光素、酶、金属离子、同位素) 显色,来对组织 (细胞) 内抗原进行定位、定性及定量的研究 (主要是定位)。
Section.05
质谱分析
Aβ40 在 AD 患者体内的丰度是 Aβ42 的 10 倍,但 Aβ42 的神经毒性比 Aβ40 强。用纳米 ESI 离子迁移质谱仪检测 Aβ40 和 Aβ42 的 1:1 混合物(用 FMOC 化学方法合成 Aβ40 和 Aβ42)发现,纯 Aβ42 的寡聚化速度比 Aβ40 快得多,导致 Aβ42 快速耗尽 (图 4a)[6]。CSF 中 Aβ42 与 Aβ40 的比率有助于评估 AD,但定量受到包括分析前分析物损失等因素的限制。高通量 LCMS/MS 技术可以限制分析物损失,对临床的 CSF 标本分析显示 AD 和轻度认知障碍 (MCI) 患者中 Aβ42/Aβ40 比值和 Aβ42 浓度都降低[15],进一步证实 Aβ42 的寡聚化是 AD 的重要原因 (图 4b)。
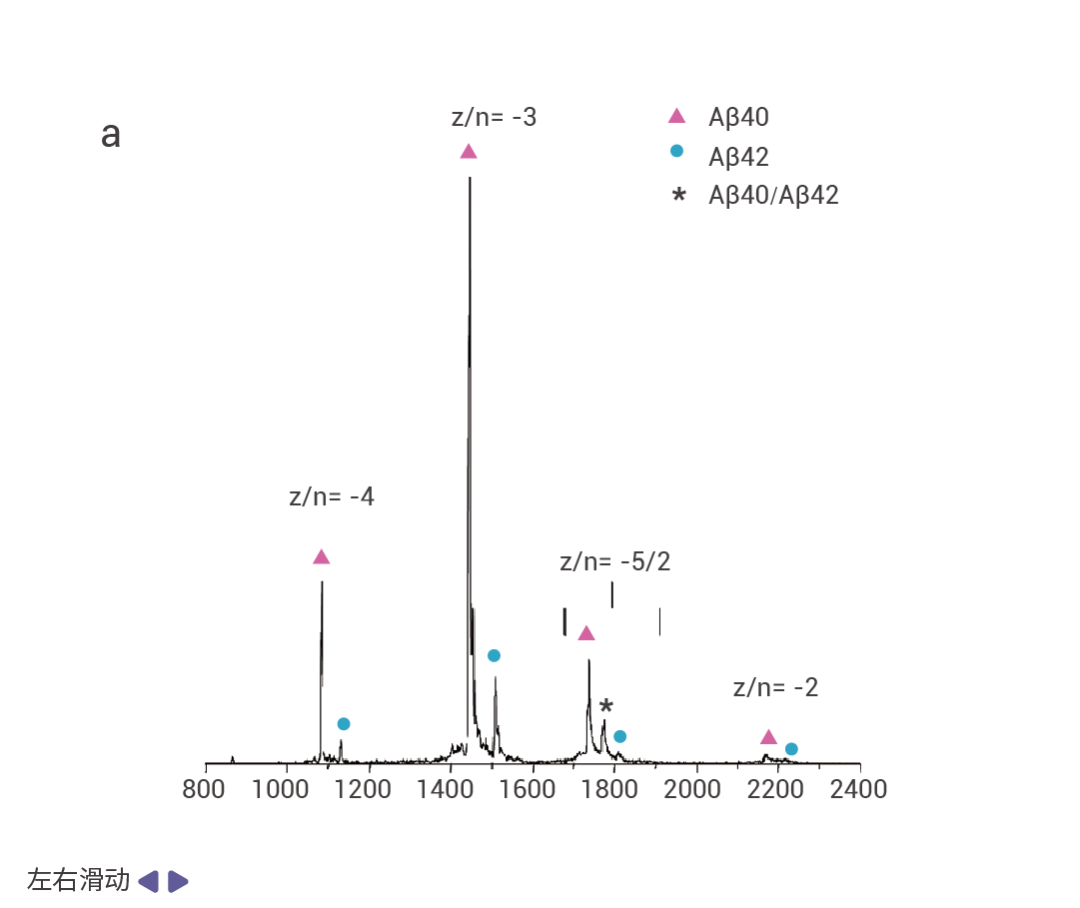
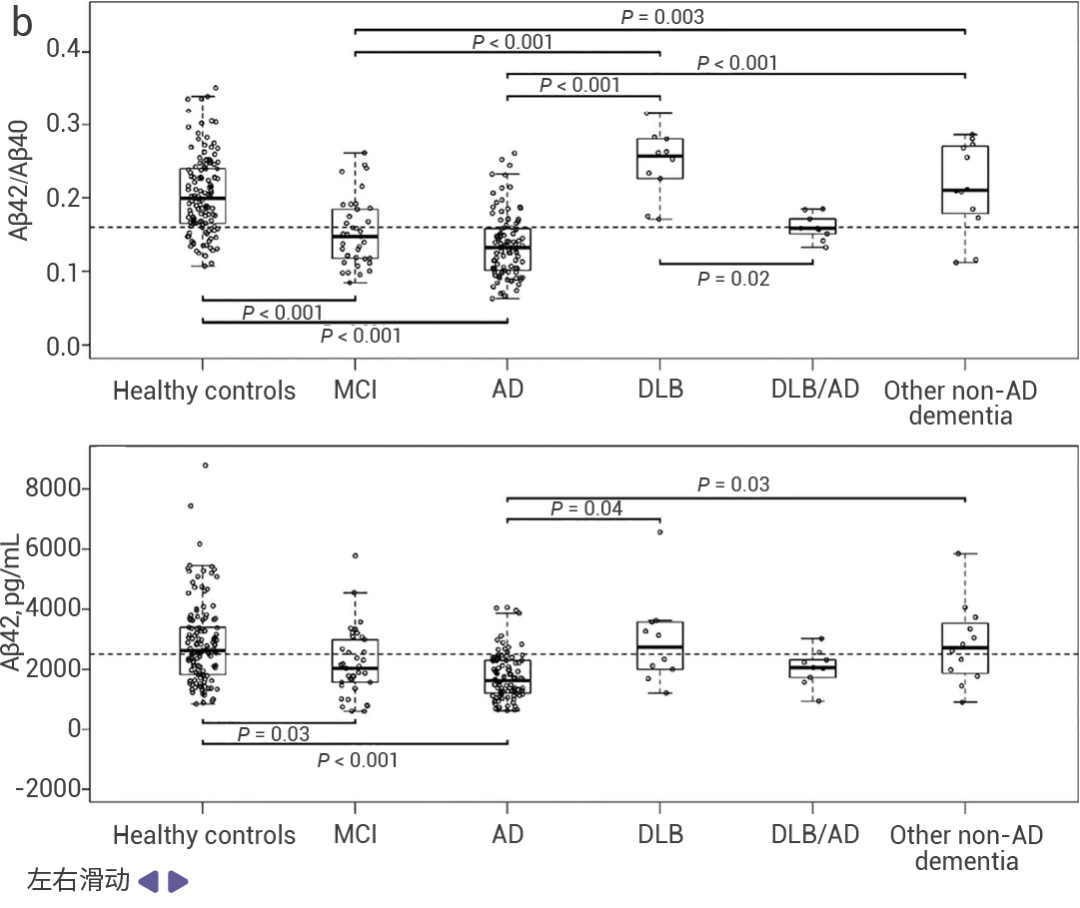
图 4. Aβ42/Aβ40 比值和 Aβ42 浓度在 AD 和 MCI 患者中都降低[7]。
a. Aβ40 和 Aβ42 的 1:1 混合物的负离子质谱[14]。b. Aβ42/Aβ40(上)和 Aβ42(下)在 AD、MCI、DLB/AD、健康对照、非 AD 痴呆和伴或不伴 AD 的 DLB 中的分布 (MCI:轻度认知障碍;DLB:路易体痴呆)。
04小贴士LCMS/MS 基本原理:样品通过液相色谱分离后的各个组分依次进入质谱检测器,各组分在离子源被电离,产生带有一定电荷、 质量数不同的离子。不同离子在电磁场中的运动行为不同,采用质量分析器按不同质荷比(m/z)把离子分开,得到依质荷比顺序排列的质谱图。
Section.06
免疫荧光
神经元内 Aβ42 在 AD 或 DS 切片中具有胞质颗粒免疫反应性[8],主要定位于神经元的突触前,尤其是突触后隔室内的多泡体中积累,但由于很快被大脑中的小胶质细胞清除,因此不容易观察到。在唐氏综合症 (DS) 星形胶质细胞中使用针对 Aβ42 C 端产生的单克隆抗体进行了免疫荧光显微镜观察,显示 DS 星形胶质细胞中 Aβ42 呈囊泡状分布 (图 5a)[9]。细胞内 Aβ42 能直接激活 p53 启动子,导致 p53 依赖性细胞凋亡。此外,氧化 DNA 损伤诱导了豚鼠原代神经元中 Aβ42 的核定位和 p53 mRNA 升高。氧化 DNA 损伤可能诱导 Aβ42 在胞质溶胶中积累,然后依次在激活 p53 级联反应的细胞核中积累 (图 5b) [10]。
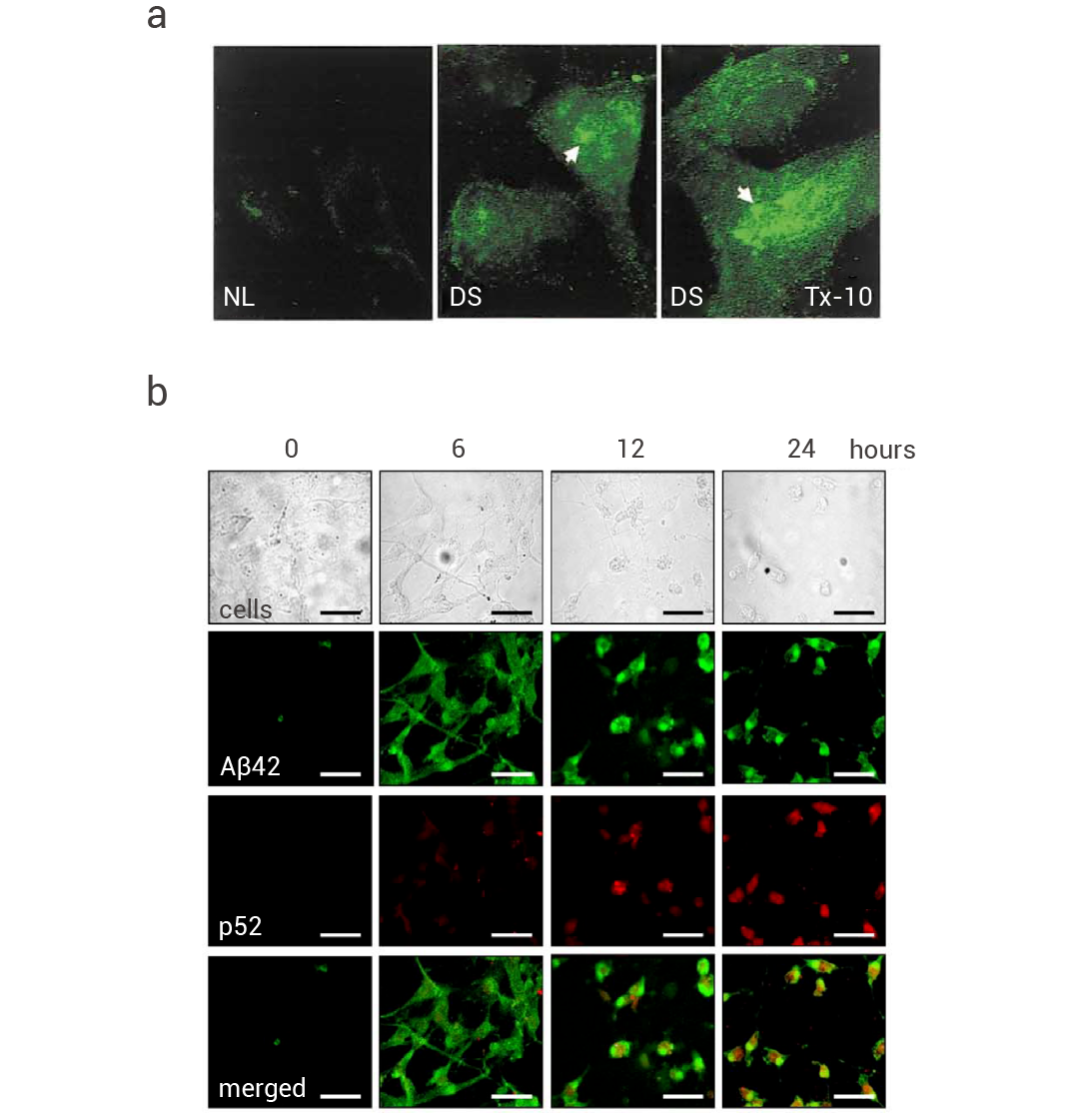
图 5. Aβ42 呈囊泡状分布,且氧化 DNA 损伤诱导了 Aβ42 的核定位[9][10]。
a. 正常 (NL) 和 DS 星形胶质细胞中对 Aβ42 进行免疫荧光检测 (上)[9]。b. H2O2 诱导胚胎豚鼠脑细胞中 Aβ42 (绿色) 和 p53 (红色) 的双重免疫染色 (下)[10]。
05小贴士IF 基本原理:根据抗原抗体反应的原理,先将已知的抗原或抗体标记上荧光基团,再用这种荧光抗体(或抗原)作为探针检测组织或细胞内的相应抗原 (或抗体)。利用荧光显微镜可以看见荧光所在的组织,从而确定抗原或抗体的性质和定位,以及定量 (荧光面积或平均荧光强度等)。
Section.07
流式细胞术
Aβ 肽的异常神经元积累会影响突触传递并导致 AD 大脑的神经退化。其中 Aβ40 和 Aβ42 能扰乱神经元细胞的内吞作用和细胞内运输。利用分析流式细胞术用 Aβ42 特异性抗体检测 AD 患者额叶皮层和纹状体中发生的突触变化,发现严重 AD 患者大脑皮层中 Aβ42 阳性突触体的数量增加,并在人皮质突触体中积累 (图 6a-c)[11]。此外,Aβ40 通过减少 PC12 细胞对 F-Aβ42 (荧光素标记的 Aβ42) 的摄取来减少 Aβ42 在神经元内积累和溶酶体定位 (图 6d-f)[12]。
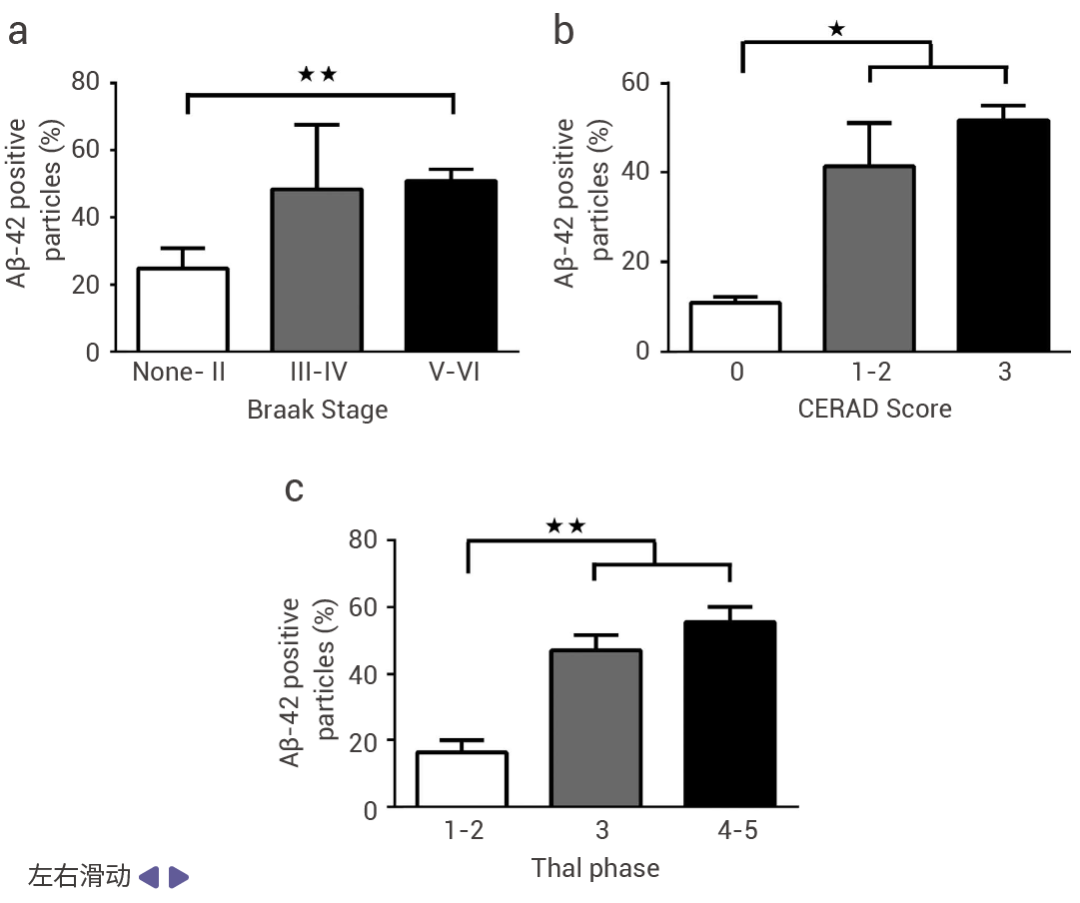
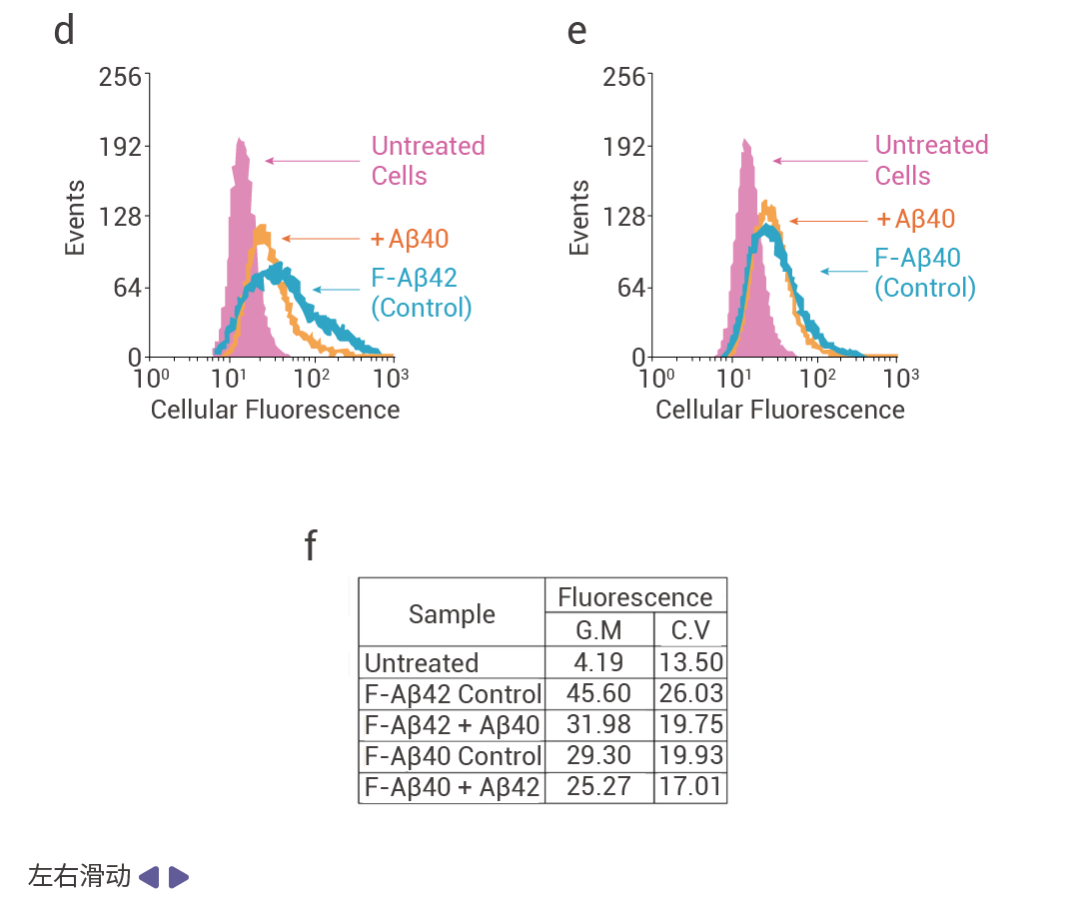
图 6. AD 患者大脑皮层中 Aβ42 阳性突触体的数量增加[11][12]。
(a-c) 用抗 Aβ42 抗体检测 AD 患者皮质突触体中 NFT 分布的 Braak 阶段系统,神经炎斑块密度的 CERAD 评分和 Aβ42 斑块分布的 Thal 期[11]。(d)Aβ40 抑制分化的 PC12 细胞中对 F-Aβ42 的摄取细胞内荧光的流式细胞术直方图显示 Aβ40 预处理细胞中 F-Aβ42 摄取的抑制;(e)F-Aβ40 的摄取不受 Aβ42 预处理细胞的影响。(f)细胞内荧光的几何平均值[12]。
06小贴士FC基本原理:利用激光激发带有荧光标记的微粒,检测其散射光信号和荧光信号,从而反应微粒的各个参数,并将特定性状的微粒分选出来。
Section.08
表面等离子体共振
在正常生理条件下, Aβ42 和 Aβ40 肽以 1:9 的比例共存于大脑中。而在家族性 AD 患者的大脑中,该比率通常转变为 Aβ42 的较高百分比,导致突触毒性增加。据报道,尽管这两种肽的化学性质非常相似, Aβ42:Aβ40 比率的微小变化会极大地影响神经毒性寡聚体的形成。利用 SPR 技术表征了不同生物素化的 Aβ42:Aβ40 比率的开始和结束状态,并证实了 Aβ42 和 Aβ40 可以直接相互作用,并且它们相互影响各自的聚集行为 (图 7)[13]。
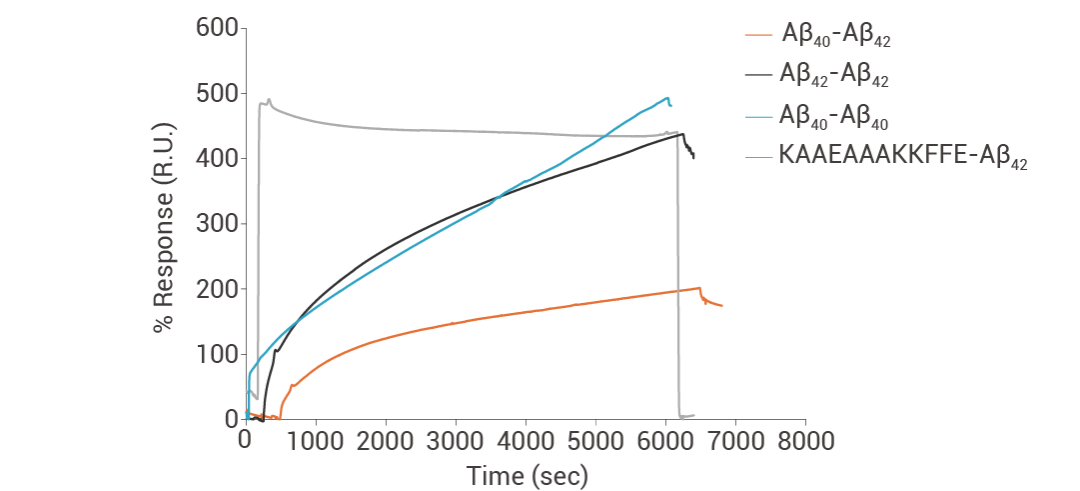
图 7. Aβ42 和 Aβ40 直接相互作用[13]。
07小贴士SPR 基本原理:指金属表面的电子以及周围介质中的电子,以特殊频率的共振而产生的一种特殊的电磁波,可以检测抗原与抗体、DNA 与蛋白、蛋白与蛋白之间的相互作用。
产品推荐
| β-Amyloid (1-42), human (HY-P1363A)
淀粉样蛋白 β 肽 (1-42) 片段
| β-Amyloid (1-42), human TFA (HY-P1363)
淀粉样蛋白 β 肽 (1-42) 片段盐形式
| β-Amyloid (1-40) (TFA) (HY-P0265A)
淀粉样蛋白 β 肽 (1-40) 片段盐形式
| Tau Antibody (HY-P80909)
非偶联、约 79 kDa、兔源、抗 Tau 单克隆抗体。用于 WB 实验
| Phospho-Tau (Thr181) Antibody (HY-P80861)
非偶联、约 79 kDa、兔源、抗磷酸化 Tau (Thr181) 单克隆抗体。用于 WB,I F 实验。
| Phospho-Tau (Ser396) Antibody (HY-P80480)
非偶联、约 79 kDa、兔源、抗磷酸化 Tau (S396) 单克隆抗体。用于 WB,ICC/IF、IHC-P 实验
| Phospho-Tau (Ser202/Thr205) Antibody (HY-P83700)
非偶联、约 79 kDa、兔源、抗磷酸化 Tau (S396) 单克隆抗体。用于 WB、ICC/IF、IHC-P 实验
|
参考文献:
[1] Teunissen CE, et al. Plasma Amyloid-β (Aβ42) Correlates with Cerebrospinal Fluid Aβ42 in Alzheimer's Disease. J Alzheimers Dis. 2018;62(4):1857-1863.[2] Bitan G, et al. Amyloid beta -protein (Abeta) assembly: Abeta 40 and Abeta 42 oligomerize through distinct pathways. Proc Natl Acad Sci U S A. 2003 Jan 7;100(1):330-5. [3] Vosough F, et al. Characterization of Homogeneous and Heterogeneous Amyloid-β42 Oligomer Preparations with Biochemical Methods and Infrared Spectroscopy Reveals a Correlation between Infrared Spectrum and Oligomer Size. ACS Chem Neurosci. 2021 Feb 3;12(3):473-488. [4] Pujol-Pina R, et al. SDS-PAGE analysis of Aβ oligomers is disserving research into Alzheimer´s disease: appealing for ESI-IM-MS. Sci Rep. 2015 Oct 9;5:14809. [5] Gouras G K, et al. Intraneuronal Aβ42 accumulation in human brain[J]. The American journal of pathology, 2000, 156(1): 15-20. [6] Murray MM, et al. Amyloid beta protein: Abeta40 inhibits Abeta42 oligomerization. J Am Chem Soc. 2009 May 13;131(18):6316-7. [7] Weber DM, et al. High-Throughput Mass Spectrometry Assay for Quantifying β-Amyloid 40 and 42 in Cerebrospinal Fluid. Clin Chem. 2019 Dec;65(12):1572-1580.
[8] Takahashi RH, et al. Intraneuronal Alzheimer abeta42 accumulates in multivesicular bodies and is associated with synaptic pathology. Am J Pathol. 2002 Nov;161(5):1869-79.
[9] Busciglio J, et al. Altered metabolism of the amyloid beta precursor protein is associated with mitochondrial dysfunction in Down's syndrome. Neuron. 2002 Feb 28;33(5):677-88.
[10] Ohyagi Y, et al. Intracellular Abeta42 activates p53 promoter: a pathway to neurodegeneration in Alzheimer's disease. FASEB J. 2005 Feb;19(2):255-7.
[11] Postupna NO, et al. Flow cytometry analysis of synaptosomes from post-mortem human brain reveals changes specific to Lewy body and Alzheimer's disease. Lab Invest. 2014 Oct;94(10):1161-72.
[12] Omtri RS, et al. Differential Effects of Alzheimer's Disease Aβ40 and 42 on Endocytosis and Intraneuronal Trafficking. Neuroscience. 2018 Mar 1;373:159-168.
[13] Pauwels K, et al. Structural basis for increased toxicity of pathological aβ42:aβ40 ratios in Alzheimer disease. J Biol Chem. 2012 Feb 17;287(8):5650-60.
|  |手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033
|手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033