金币
UID24640
帖子
主题
积分18543
注册时间2012-3-30
最后登录1970-1-1
听众
性别保密
|
欢迎您注册蒲公英
您需要 登录 才可以下载或查看,没有帐号?立即注册
x
来源:CFDI 网站
国家食品药品监督管理总局食品药品审核查验中心发布《2015年度药品检查报告》, 对全年药品检查情况及检查发现主要问题进行了阐述,分别对各类检查发现的主要问题进行了分析。
第七节 国外监管机构GMP检查的观察核查中心组织药品GMP检查员参加各类国际药品GMP检查观察工作。全年完成检查观察74次,包括批准前检查、跟踪检查和飞行检查等不同类型。任务涉及浙江、上海等18个省市,其中浙江、上海、广东、江苏、河北、山东占全部任务量的77%。
全年检查观察的国外药品检查机构包括:世界卫生组织(WHO)、欧洲药品质量理事会(EDQM)、美国食品药品监督管理局(US FDA)、德国汉堡健康及消费者保护部(BGV)、英国药品和医疗产品监督局(MHRA)、法国国家医药健康安全管理局(ANSM)、巴西卫生监督局(ANVISA)等10个国际组织或国外政府部门。
二、发现主要问题
全年国际药品GMP检查观察工作中共记录缺陷826项,依据我国药品GMP(2010年修订)正文章节对缺陷项进行分类分析发现:质量控制与质量保证、物料与产品、生产管理、文件管理、设备、确认与验证六个类别的缺陷占了全部缺陷的83.9%。缺陷项目的分布情况与国内检查发现的缺陷项目分布类似,同时与境外检查发现的境外生产企业存在的缺陷问题分布相似。特别是备受关注的数据可靠性问题,在国内外的药品生产企业中也普遍存在。
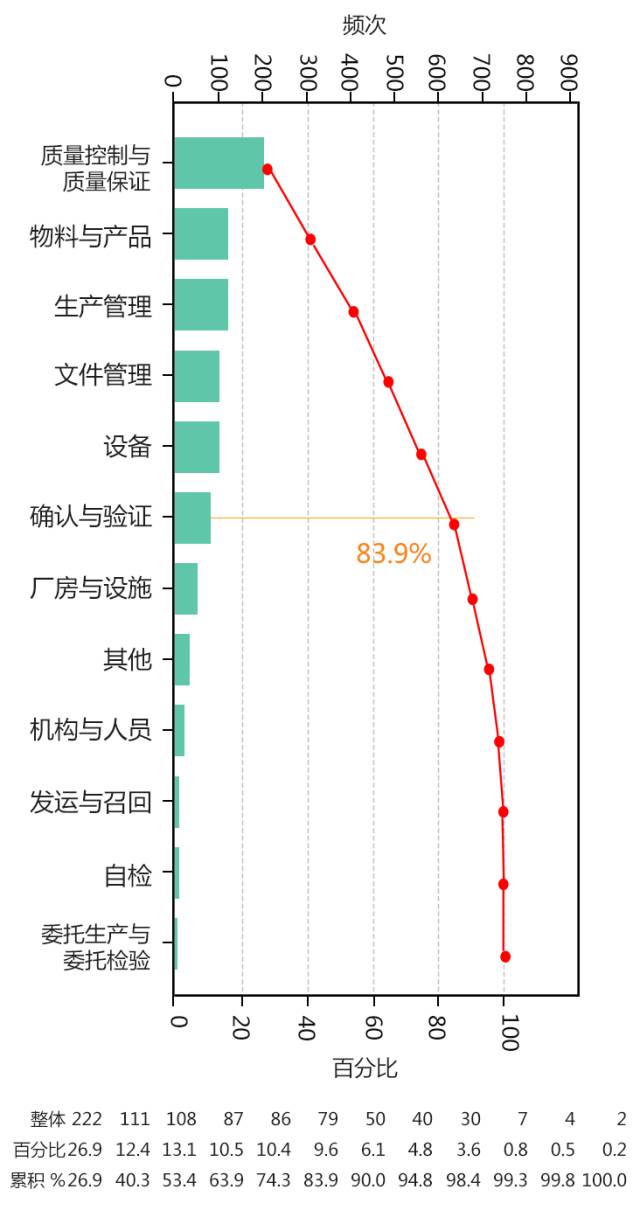
在检查发现的缺陷中,“质量控制与质量保证”部分提出的缺陷占总缺陷数的26.9%,位居首位。主要集中在偏差管理、实验室计算机化分析仪器的管理、年度质量回顾、OOS/OOT结果处理、实验室未遵循控制程序的规定、分析仪器管理、变更控制、取样、留样管理等方面。“物料与产品”部分出现的缺陷位居第二位,出现的缺陷项集中在物料流程管理(包括采购、接收、贮存、放行、发放、使用、退库、销毁)、产品流程管理、供应商管理、标识管理等方面。“生产管理”部分出现的缺陷数居第三位,主要包括防止污染与交叉污染、生产操作、设备、标识、包装操作等方面的问题。
|
|
 |手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033
|手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033