欢迎您注册蒲公英
您需要 登录 才可以下载或查看,没有帐号?立即注册
x
5W(Who, What, When, Where 和 Why)是制药质量体系中广泛使用的典型工具。例如,在进行偏差描述时,通过5W工具可以实现精准的偏差描述。
上期我们解析了如何利用5W工具明确 “CSV范围”,本期我们将深化CSV主题——解析如何运用5W工具明确计算机化系统计划阶段的活动,助力企业构建合规、高效、可执行的验证体系框架。
上期内容: 《CSV系列1 | 典型工具5W在计算机化系统验证的应用》
01 CSV 计划阶段的介绍
CSV 全生命周期涵盖计划、设计、开发、测试、运行等阶段。其中,计划阶段作为 "奠基工程",需完成三大核心任务(如图1所示): 质量项目计划(QPP)制定 验证计划(VP)编制 用户需求文件(URS)编写
此外,被监管企业通常还需在该阶段启动变更控制、完成供应商评估及系统初始风险评估(如图 2 所示)。
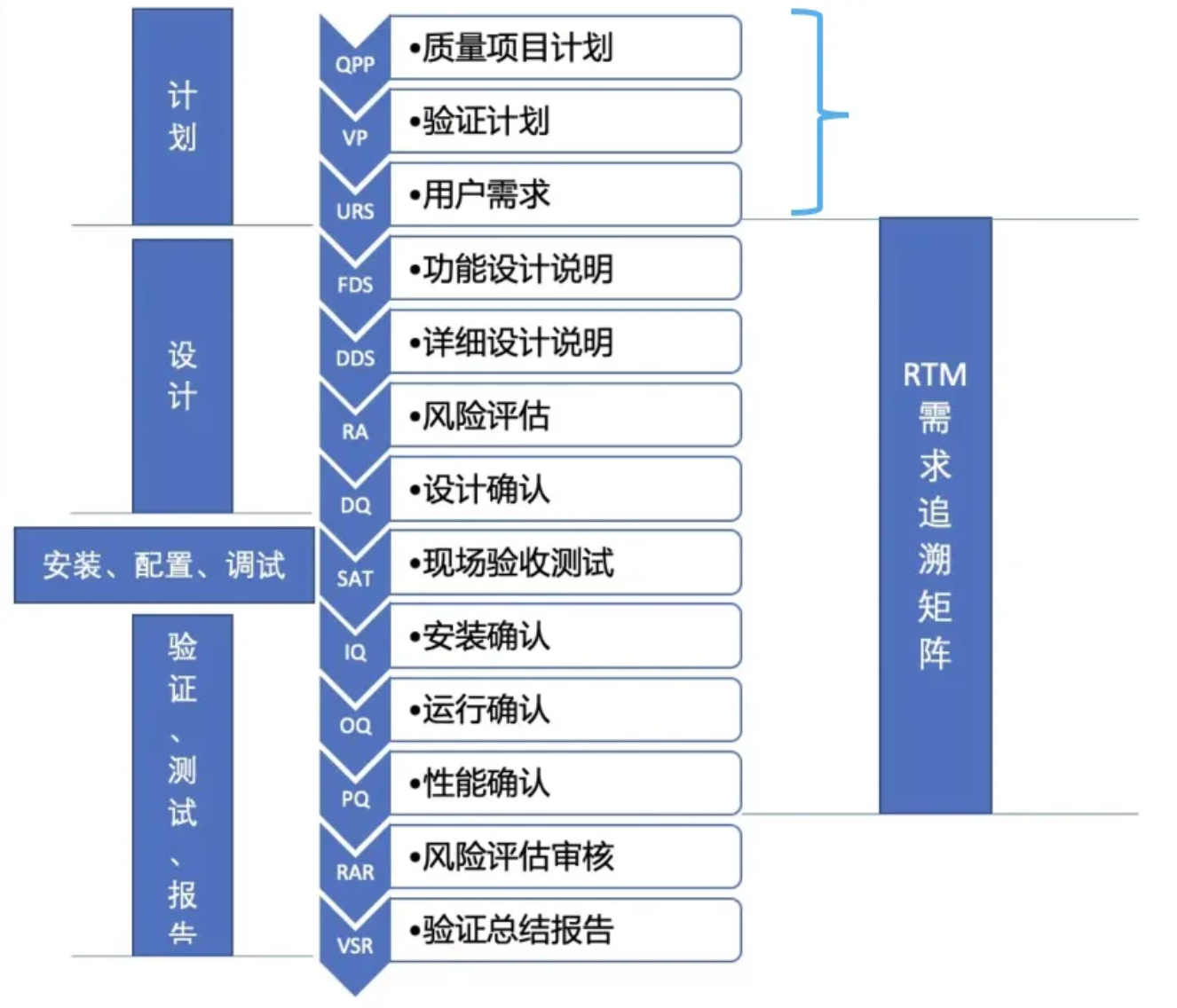
图1 计算机化系统验证流程
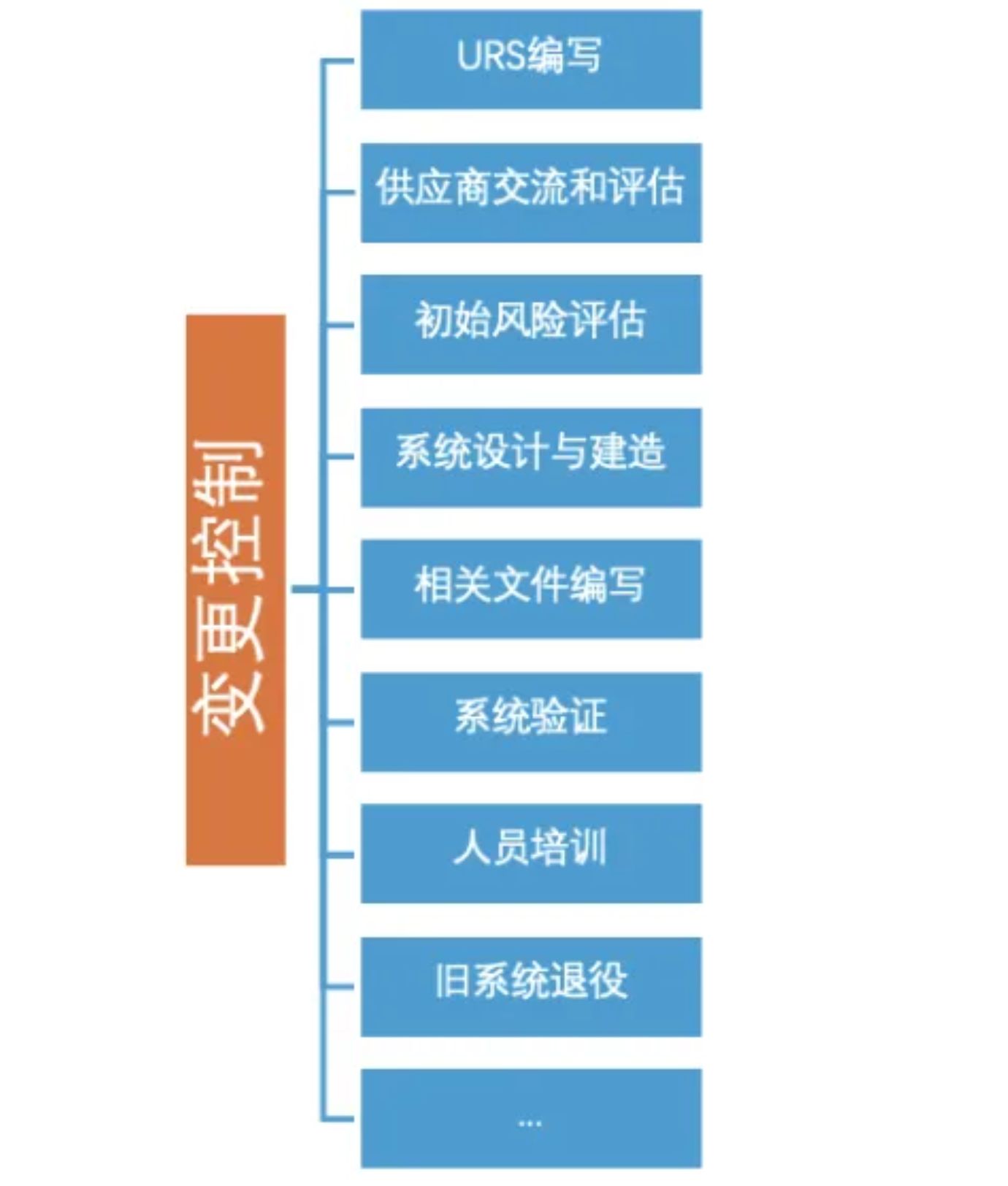
图2 变更控制的内容
02 CSV计划阶段的重要性
在项目管理中,一个科学的计划是项目成功的基石。项目计划贯穿项目全生命周期,其核心价值在于将不确定性转化为可控因素,通过系统化方法平衡目标、资源与风险,最终实现项目成功。
CSV工作同样如此,计划阶段需要定义验证策略,这直接决定了验证的合规性,以及是否以高效的方式开展;需要规划项目目标和资源配置,这些是项目成败的关键因素。所以,CSV计划阶段的工作在整个流程中是非常重要的,因此我们推荐使用“系统化”的方法,尽可能考虑到项目阶段工作的各方面。
03 5W 在“计划阶段”的应用
5W(Who, What, When, Where 和 Why)在“计划阶段”的应用如下:
1. WHO:活动相关人员的识别
在开展计划阶段的工作时,我们需要明确“谁”是相关的人员。人员通常包括:
变更控制相关:对于被监管公司,新系统的实施必然伴随着业务方式实现的变化,因此通常需要变更控制流程,对整个过程进行把控。变更控制的批准通常是后续活动的先决条件,需要识别变更控制相关人员,以确保变更的经过充分的评估和控制,并确保各项活动开展的逻辑顺序。
供应商评估相关:大型系统的供应商选择,或者大型公司的开展供应商选择,通常是需要经过复杂的筛选流程,整个流程的周期也较长。项目早期往往很多工作在并行,准确识别供应商评估人员可明确这项工作的归属和节点,确保在适当的时机完成供应商评估。
在一些验证指南中,把供应商评估作为系统验证工作的一部分,因此一些公司也会把供应商评估,作为验证计划中的一项关键活动。
用户需求相关:准确识别系统用户,收集到这些用户的需求,才能确保用户需求内容的完整性,进而开展相应的设计。不充分的用户需求可能直接导致建造的系统不符合使用要求。
“用户”有时候是个相对的概念,比如相对于技术部门,业务部门为用户;相对于外部供应商,公司内部的业务和技术部门都可以为用户。随着用户群体的变化,用户需求也是在变化的,这也导致不同公司对用户需求的理解不一致,例如,公司如果有技术部门参与用户需求的编写,用户需求可能会包含更多的技术需求内容。总的来说,识别尽可能多的用户需求,有助于项目团队在计划阶段加深对系统的理解。
质量和项目计划相关:质量和项目计划用于说明质量和项目工作安排,以及相关的资源安排,确保项目质量符合用户要求。准确识别各项工作的相关人员有助于评估确认项目资源是否充分,例如是否配置了适当的人员支持项目管理、硬件设计、软件设计、采购实施、现场安装调试与测试执行(特种作业实施)、文件准备、文件审核与批准等。
验证计划相关:验证计划中定义了项目中需要开展的验证活动,以及验证人员的职责,因此在计划阶段需要识别出这些相关人员,并组成验证小组。验证小组的成员通常包括文件的起草人、审核人和批准人,风险评估人员,测试活动的执行人和见证人,支持性活动的实施人员,如偏差/变更负责人员等。
初始风险评估相关:计划阶段的初始风险评估,需要质量部人员、技术部门和业务部门代表参与,需要识别这些评估人员开展风险评估活动。
2. WHAT:活动内容的识别
在这个问题中,我们需要识别出,计划阶段关于“什么”这些问题的答案。这里需要考虑:
变更控制相关:需要明确现状并描述,预期变更后的效果,变更用于什么目的。
供应商评估相关:除了基础的证照资质和市场信誉检查,需要考察的重点往往包括供应商的技术能力(产品成熟度、类似项目经历)和质量管理体系(项目实施管理、质量保证系统)两大方面。
用户需求相关:这里需要考虑各方面用户对系统的需求,例如业务部门用户、质量部门用户、技术部门用户。用户需求尽可能使用明确的表述,便于系统设计人员开展针对性的设计,也便于需求在后续阶段的响应和追溯。
质量和项目计划相关:需要明确客户方的质量要求,例如中国 GMP或是US cGMP;需要明确供应商的质量管理体系,例如项目或遵循哪些文件或体系的管理要求;需要明确相关的项目活动,是如何控制的,并体现在哪些文件;需要明确项目组织架构、时间计划和项目管理要求等信息。
验证计划相关:需要明确验证策略和需要开展的验证活动,角色职责、项目概述、支持性程序(偏差、变更、风险评估、文件管理等)、可接受标准、验证状态维护、验证时间计划等内容。
初始风险评估相关:需要明确初始风险评估的内容,一般来说,初始风险评估包括系统总体的GxP影响性评估(确定系统验证策略),电子记录和电子签名适用性评估(确定是否使用电子记录和电子签名代替手写记录和签名)以及软硬件初步分类评估(基于供应商或技术部门的支持,对软硬件进行分类)。
3. WHEN:时间规划
计划阶段需要识别出以下关键时间:
变更控制相关:一般来说,变更启动时间是项目工作的第一步,相关项目活动为变更的行动项,需要在变更批准实施后开展。变更关闭时间是项目的最后一步,需要在所有活动完成后,评价变更是否达到预期目的,确认是否关闭变更。
供应商评估相关:供应商评估是供应商开展项目工作的先决条件,也是变更控制的重要行动项,供应商评估通常需要在变更批准后、商务合同签订前完成。比较容易忽略的一点是,供应商的确定往往不是一蹴而就,供应商评估可能包括对多个供应商的评估,评估的结果也包括通过或不通过两种情况。
用户需求相关:用户需求的编写是系统设计和制造的基础,也是变更控制的重要行动项,通常在变更批准后完成。基于每个公司情况,可以在供应商评估前完成URS的批准,也可以基于供应商的技术支持,在计划阶段进行细化修改。考虑到验证策略的制订和项目资源的安排需要考虑用户需求,建议URS文件的正式批准最迟不晚于验证计划/质量项目计划的批准。
质量和项目相关:质量项目计划需要供应商信息的输入,和验证计划类似,为计划性质的文件。考虑到这些,质量项目计划的批准通常是合同签订后,与验证计划在相近时间节点审批。
验证计划相关:验证计划需要供应商信息的输入,同样为计划性质的文件。验证计划的批准通常是合同签订后,与质量项目计划在相近时间节点审批。
初始风险评估相关:考虑到GxP影响性评估结果将决定影响验证策略的制定,软硬件分类评估需要供应商的技术信息输入,建议初始风险评估和验证计划在同一时间节点进行审批。一些公司的管理体系也可能将初始风险评估的各方面分开来评估,时间节点也遵循这个原则。
4. WHERE:地点确定
在这里我们需要确定计划阶段的一些关键地点:
变更控制相关:需要考虑的地点因素主要是变更活动影响的地点,例如,某厂区/车间、IT机房、制水间等,这些需要在变更影响评估中准确识别并记录。
供应商评估相关:需要考虑的地点包括供应商公司所在地(如果采用现场审计),示例项目所在地(如果决定需要做样例项目考察)。
用户需求相关:需要考虑不同厂地用户的需求(如集团级系统,涉及多个场地的用户)。
质量和项目计划/验证计划相关:需要考虑典型活动的实施地点例如供应商内部测试、工厂验收测试,现场验收测试、安装、运行、性能确认的实施地点。清晰的了解这些地点有助于项目团队对活动的理解。
初始风险评估相关:初始风险评估没有明显的地点特征。随着技术发展,尤其是疫情的影响,很多文件签批存在共同点是,评估和签字人员不在同一地点,可能需要协调文件的签批和流转。常见的方式包括线上的集中评审(邮件、共享盘、线上会议等)、邮寄签批、扫描件签批等。
5. WHY:目的
系统为什么要进行计划阶段活动呢?
变更控制相关:这里本质与质量管理体系的变更控制目的一致,是为了规范原辅计算机系统变更的申请、评估、审核、批准和实施,使系统维持在验证状态而确定需要采取的行动并对其进行记录。确保变更及其对产品的验证状态、安全性、鉴别、含量、纯度、法规文件和质量的影响均得到评估。
供应商评估相关:供应商评估的目的是为了确保供应商具备相关资质,有能力提供相关产品和服务,并充分的利用供应商的知识、经验和文件,并最终确保系统符合预期用途。
用户需求相关:URS的目的是为了完整准确记录用户需求,作为系统设计的基础,进而保证设计、建造的系统符合预期用途。
质量和项目相关:目的是为了说明满足用户需求而必须采取的措施,界定了项目的生命周期及相关工作,说明为完成项目而专门组织配备的项目团队及其职责。
验证计划相关:目的是为了说明在整个确认与验证过程中,验证所有参与方的职责,以及验证策略,说明验证活动计划和验证活动支持程序,最终确保系统符合URS及设计文件要求,并最终符合相关GMP法规的要求。
初始风险评估相关:目的是为了在项目早期阶段识别相关的风险,并确定控制措施。这里对应的控制措施通常为策略性的,例如系统是否需要开展验证,如需要,验证活动需要到什么样的程度(典型的,例如是否需要开展源代码审核)。
04. 德恩咨询计算机化系统专家
靳老师 CS合规负责人
以上是德恩咨询对5W在计算机化系统计划阶段实践应用的分享。如果您喜欢,请将本文章转发给更多人吧~
接下来,我们将会继续分享CSV整个流程的知识,请关注我们公众号“德恩GMP咨询”,第一时间获取技术文章干货,避免错过每期精彩分享!
P.S. 本文章为gempex德恩咨询原创。如需转载,请注明来源于gempex德恩咨询。
欢迎垂询 服务热线:400-166-2002
关于gempex德恩咨询 德恩咨询是gempex在中国的全资子公司,是具有国际影响力的GMP咨询与执行机构,致力于为全球的生命科学企业提供合规、高效及可执行的GMP解决方案。经过23年的发展,我们拥有60多位经验丰富的GMP专家,全球累计执行项目超过5000个,累计为1000多个客户提供专业服务,业务遍布20多个国家,并与众多知名药企建立了长期的合作关系。 我们的专家团队拥有丰富的行业经验,熟知NMPA、FDA、EU、WHO、ICH、PIC/S、MHRA、SWISSMEDIC、TGA等GMP法规要求,能为不同国家和地区的客户提供定制化的解决方案,服务包括全球GMP符合性、新厂房合规性、CS计算机化系统、工厂质量管理和多国MAH/MAA服务。 
|  |手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033
|手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033