欢迎您注册蒲公英
您需要 登录 才可以下载或查看,没有帐号?立即注册
x
【原创】参比制剂,原研药品与地产化疑问汇总
蒲公英原创,转载请注明并与作者联系

原研药品是指在全球市场率先上市的,拥有或曾经拥有相关专利、或获得了专利授权的原创性药品。[size=14.6667px]参比制剂的确定,要求必须是原研药或欧美获批的参比制剂地位的药物,那么对于企业来说,找到产品的源头很重要,对一些原来以市场占有量大的产品作为自己产品的参比制剂的厂家来说,查外文文献查专利查其他各国的药监局网站成为近期的工作重点。大多原研药是该化学结构的发现者,企业在剂型的开发上也多有涉猎,如耐信有普通片剂和缓释剂型可作为参比制剂,由于两种剂型在体外溶出及体内释放、吸收完全不同,国内企业在选择对照品时应谨慎。找到源头药品本不是一件容易的事,比如在美国FDA及欧盟医药管理局EMA网站上下求索也没有找到“氨溴索”和“法舒地尔”的原研及获得参比制剂地位的相关信息,更何况茫茫众多的老药去哪里寻找源头?然而就算找到了源头药品还不是终点,如何做到与原研药的质量一致,查找质量标准是又一个不得不迈的坎。如果国内有该原研品种销售,好办,可以在药监局及药检所等机构查到该产品的质量标准;如果没有进口,对不起,查该国药典或文献或别的相关资料是必修课。
1.法规方面的论述:
根据二、选择原则
参比制剂首选原研药品,若确实无法获得原研药品或有证据证明原研药品不适合评价方法要求时,也可以选用国际公认的同种药物作为参比制剂。
(一)首选国内上市的原研药品作为参比制剂。如原研企业同时有进口和地产化药品的上市许可,优先选择进口原研药品作为参比制剂。若原研药品未在国内上市,可选择在国外上市的原研药品。优先选择在欧盟、美国上市并被列为参比制剂的原研药品。
(二)国际公认的同种药物首选国内上市药品。如企业同时有进口和地产化药品的上市许可,优先选择进口药品作为参比制剂。若国际公认的同种药物未在国内上市,则选择在欧盟、美国上市并被列为参比制剂的同种药物。
(三)参比制剂的质量及均一性应满足药品评价要求。
指出参比制剂首选国内上市的原研药品。若原研企业能证明其地产化药品与原研药品一致,地产化药品也可作为参比制剂使用。
2.国内原研目前有几种情况:
1、进口药品和国产药品都有,如阿托伐他汀钙片,国产药品按新药申报获批;
2、只有进口药品,如枸橼酸西地那非片,国产药品按1类新药申报获批;
3、只有国产药品,如托吡酯片,国产药品按新药申报获批。
问题:
1、原研地产化的定义到底是啥啊?有按仿制药申报的原研药品吗?
2、既然地产化原研都是按照新药申报做的临床,并未桥接国外临床安全有效性数据,为什么现在要与国外原研进行一致性评价呢?
3、虽然一致性评价的对象是“化学药品新注册分类实施前批准上市的仿制药,包括国产仿制药、进口仿制药和原研药品地产化品种,均须开展一致性评价”,但是原研地产化要做一致性评价,按照这个思路,以前批准的国产2~5类是不是也要做一致性评价?
1、原研地产化按之前的分类大部分是3类新药申报的,不排除国内已经有上市的,原研地产化进来比较晚,按6类申报,应该极少。
2、2-6类都需要做一致性评价的,要跟原研对比,包括原研地产化。但是原研地产化可能会简单些,可能只需提供一些资料视为过一致性评价
3.疑惑,如何证明地产化药品与原研药品一致?
参比制剂选择原则中第一条:(一)参比制剂首选国内上市的原研药品。作为参比制剂的进口原研药品应与其原产国上市药品一致。若原研企业能证明其地产化药品与原研药品一致,地产化药品也可作为参比制剂使用。
我们看后两句话:
1、作为参比制剂的进口原研药品应与其原产国上市药品一致。我觉得这是废话,不一致你当时能允许他进口吗?你能给他发进口批文吗?你已经批准他进口上市这么多年了,现在冒出这样一句话。
2、若原研企业能证明其地产化药品与原研药品一致,地产化药品也可作为参比制剂使用。还是一样的道理,你都批准他地产化了,你还不知道他地产化药品与原研药品是否一致?还要说若....一致,则.....,你是想让仿制企业去向原研企业要这个证明吗?这难道不是你在发批文前应该干的事吗?
4.特殊品种有差异的,比如两个日本品种,
一个日本原研片子,日本上市不包衣,而在美国、欧洲、中国上市均包衣
另一个日本原研片子,日本上市片子室温保存,中国上市为阴凉保存。
是有差异的,但究竟以何种作为参比制剂,中国上市和日本上市的处方不一致时,
CFDA是以何种理由批准的?还是另外做了临床,不过据了解,日本企业在中国
还是很严谨的,至于产品为何这样,也无从得知了。
可见一致性评价,从参比制剂的选择开始,就有文章,希望一致性评价过后,我们
国产药也能获得和外资药同等待遇,将国产药和外资药放在同一起跑线上。
另外,涉及产品的原辅料,国外和国内的水平不一样,就算进口药品地产化了,如果用
国产原料和辅料,就算0天一样,在稳定性试验的表现也有可能与国外的不一致,原料
可能最近已经可以和国外有的一拼了,但辅料这块,还是有问题的,另外,国产的辅料
多个供应商的,尽管都符合药用标准,在实际作用上尤其是功能性辅料,也存在不一致。
所以一致性评价,最终是以BE为标准,也是无奈之举吧。
5.一致性评价,外企其实也要准备起来了。
话说回来,不同时代技术要求不同,按现在的技术要求,地产化的产品也不一定能符合要求。还有一点要知道,虽然是原研厂家的地产化,但是生产管理却是中国人,国内的制度,也许是国内的设备或辅料,难免该产品的生产工艺会与原产国的不同,当然品质也会有差别。一句话,地产化产品就是原研厂家仿制自家的产品。
对于进口的产品,好多老品种因各种原因已经不在原产国生产,而是原研厂家转移到其他劳动力成本比较低的国家去生产,所以说这类产品应和原产国一致并没有错。其实这就体现了制剂工艺的复杂性,不同厂家,不同设备,不同辅料对制剂的品质都会有影响,并且原研厂家也会不断的对其产品工艺进行优化变更。可见国家一而三,再而三的强调与原研一致,说明国家的管理思维在发生改变。
仿制药并不能完全代替原研产品,在疗效上总会有差别。
6.新药分类方面的疑惑:
新分类中原研在国内上市,是否包含地产化的?
新注册分类的3类和4类定义里,什么叫“原研在国内已上市”?地产化的算不算已上市?
一致性评价中,“作为参比制剂的进口原研药品应与其原产国上市药品一致。若原研企业能证明其地产化药品与原研药品一致,地产化药品也可作为参比制剂使用”,意味着CFDA潜意识里是不承认地产化=原研进口的,是不是只有进口的原研才算?!
国家局为了公平起见,没有直接授予原研地产化产品参比制剂资格,也说明对于地产化品种临床数据的不认可,从临床的角度来讲是合理的,毕竟地产化品种的临床也是在国内做的。
根据文件理解,只有原研地产化而没有原研进口的品种,应属于新注册分类3类,研究过程中参比制剂的选择也应选用原研原产国上市的产品,这可能对于部分品种来讲非常的有困难,如此也可能导致一些原研公司只是申报原研地产化品种的一致性评价,而不申请作为参比制剂,同时控制好原产国的产品流通渠道,这样岂不是要断了国内仿制药企业开发此类品种的通道。真真希望国家局对于原研企业给点压力,让他们的地产化品种尽快获得参比制剂资格,如此方能加快国内仿制药企业一致性评价的脚步,甚至是加快未来国内仿制药研发的步伐。
7.地产化与原研药具体问题
例如:某药原研药为辉瑞公司的,在进行进口注册时生产国不在美国、欧洲或日本,在一些小的国家,那么请问:
原研药是否就选择这个小国家生产的?
日本武田在中国上市的苯甲酸阿格列汀片(商品名:尼欣那),武田的是原研药,在国内上市的算是地产化原研药还是进口仿制药?
原研的地产化产品一般情况下不能用作参比制剂,国家局下一步打算也要外企证明自己地产化的原研药与国外欧美日上市的产品一致。
即便通过了,也不能用原研的地产化产品作为参比制剂。原因很简单,不能仿制仿制药。因为如果国家要求外企证明原研的地产化产品与国外欧美日上市产品的一致性,那么在国家局看来原研的地产化产品与国外欧美日上市产品不是一回事,其实,把原研的地产化产品看成仿制药就好理解了。
当然,后续还要关注国家局的动向。
以下请参考:
化药重复申报量最大品种的参比制剂
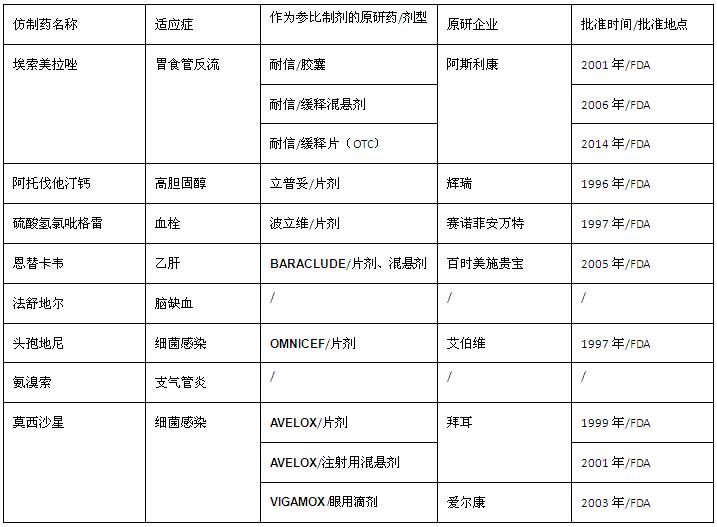
 2014年HKMED原研药提供目录(参比制剂).xls
(1.39 MB, 下载次数: 72, 售价: 1 金币)
2014年HKMED原研药提供目录(参比制剂).xls
(1.39 MB, 下载次数: 72, 售价: 1 金币)
|  |手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033
|手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033