今年恰逢建国70周年,全国人民爱国热情空前高涨,《我爱你中国》这首歌在街头巷尾被所有人传唱,《我和我的祖国》成了国庆档电影票房之王,然而10月1日正当全国人民载歌载舞欢庆建国70周年之时,由上海医工院的一封警告信一石激起千层浪,在民族情绪高昂的背景下也激起了全国人民对美帝的愤怒。可事实真的如大家所想的那样吗?2018年的另一起大事件—缬沙坦事件在2019年持续发酵,华海不出意外也收到了FDA的警告信,且自己总部的API设施在今年五月份的检查中又被FDA出示了OAI,天宇的两个设施在四月份的FDA检查中也中枪,分别拿到了OAI,全球范围的召回进行得可谓相当惨烈。真不晓得华海和天宇何时能迈过这个坎!
欧洲方面华海的帽子好不容易摘掉了,但是齐鲁天和的帽子还没有摘掉。国内另一个制药行业的巨头海正位于椒江的两个设施又于今年7月收到了西班牙的不符合报告,在其内部架构交替变更之时还真是有点雪上加霜的味道!10月份法国给了江西东风无菌原料药不符合报告,11月份,华北制药华民又收到了克罗地亚官方检查无菌原料药的不符合报告,可以预见明年这几家大药企的出口会受到比较大的影响。
而药监官方方面,今年也是流年不利,欧洲药监局EMA因为英国脱欧的影响于1月份搬到了荷兰首都阿姆斯特丹,搬家的影响前前后后持续了有将近1年,一些非核心的任务被搁置或延期,而从12月24日开始FDA因为美国政府的停摆,也被迫停摆35天,创下了停摆最长时间新纪录!
在这里,也想问一下制药行业的同行们,这一年是否是您历史上最为艰难的一年?但是会不会是未来五年内最为轻松的一年?在这里我们所作的统计和记录是为了将来能更好地进行回顾和总结。
一、欧盟C GMP检查数据汇总分析
(一)、2018~2019年度欧盟不符合报告分析
2019年对于欧盟来讲是个动荡的一年,截至到2019年11月底,欧盟官方在2019年度只进行了2482次现场检查,公布了15份GMP不符合报告,远远低于历史水平,笔者对于这些报告进行了简单的统计分析。
从历史数据来看,欧盟官方的检查数量从2016年度一直到2018年都是处于增加的趋势,但是在今年相对于去年却下降了50%之多,相应的欧盟之外第三国的现场检查数量也明显减少,都处于5年内最低水平,具体数据请见表1,究竟是今年欧盟对药企的监管放松了?还是药企的GMP水平提高了?笔者认为这恐怕受英国脱欧的影响更大,脱欧直接导致EMA搬到阿姆斯特丹,办公地点改变的导致大约25%的人员变动,从而会严重影响了EMA至少半年的正常运作,大约这是导致欧盟官方不得不暂且放松对制药企业的监管的主要原因。但是从表2中统计的几个主要欧洲国家的检查次数来看,虽然脱欧搞得大部分欧洲国家鸡飞狗跳,但是好像并没有影响到MHRA对制药行业的监管,可见MHRA作为欧盟的老大哥,其地位和能力是毋庸置疑的,而其他几个主力国家的检查数量却都有了明显的下降。时间是治愈一切的良药,笔者相信随着时间的迁移,新的雇员慢慢都会就位,相信欧盟官方的检查会逐渐正常起来,让我们拭目以待明年的统计数据。
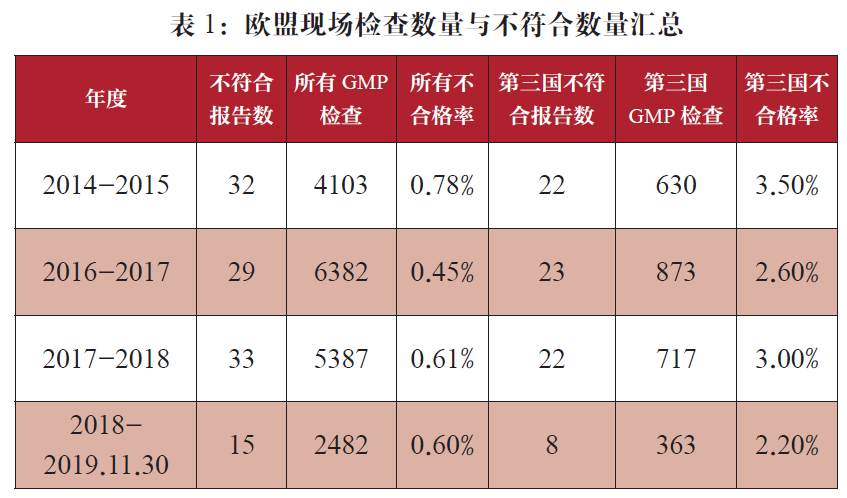
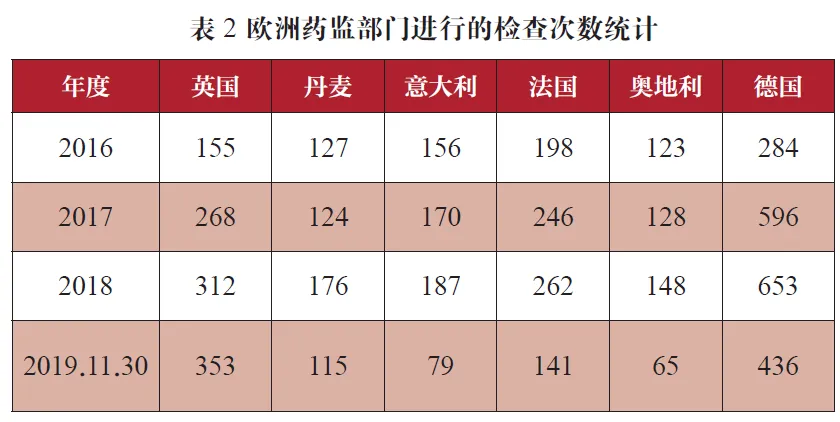
图1为欧盟现场检查全球不符合工厂国家分布,从图1可以看到,虽然同样受到英国脱欧的影响,不符合报告涉及工厂的所在国家也从11个减为7个,但是排名前五名的国家与2018和2017年度相比没有变化,仍然为印度、中国(西班牙并列)、英国,以及意大利(奥地利和丹麦并列),分别有4家,3家,2家和1家工厂。结合图2看,在欧盟检查数量减少了一半的情况下,中国和印度无论是从不合格报告的数量还是比例上来看都仍然居于状元和榜眼的位置,中国作为一个制药大国,其一直处于上升的不合格率揭示了国内整体的GMP水平在世界范围内仍然还是有很大差距的,说明我们国家要想成为一个制药强国仍然有很长的路要走,而且从华海、齐鲁、海正、江西东风以及华北制药都有场地在近两年拿到了不合格报告来看,虽然也可能存在偶然因素,但是也能反映出GMP的要求是不断进步的,制药企业必须要一贯地、严格地持之以恒,才能尽量避免走弯路;从目前的数据看印度的制药企业的整体情况变化不大,但是从FDA对印度企业的监管统计数据来看,今年FDA对印度企业并不友好,具体分析见第二部分,也许明年欧盟也会随之加大对印度药企的检查力度;而英国和西班牙一直以来都是欧洲监管水平和严格程度都比较高的国家,从进行检查的数量和结果来看,其整体GMP符合性水平还是非常高而且稳定的,意大利和奥地利同样也是处于一个比较稳定的状态。而西班牙的不合格率看起来是有一个明显的增加,但是这个增长其实是因为检查数量的降低而造成的(只有去年的四分之一),所以实际上这并不能说明西班牙制药水平下降了,而且西班牙工厂的不合格报告都是西班牙官方自己检查的,反而更加说明西班牙的监管机构以及其制药企业GMP水平仍然是居于世界前列的。
图1:欧盟现场检查全球不符合工厂国家分布
图2:不符合报告数量在现场检查中的占比
图3是在2019年发出不符合报告的官方机构分布,从图3可以看到,传统监管比较严格的欧盟成员国官方,发出的不符合报告还是最多的。英国和法国一如既往处于前三的位置,而西班牙今年超越了去年的英国,取代了意大利,成为2019年度发布不合格报告最多(4份)的国家,而且也是西班牙历史上最多的一年,中国企业海正收到的不合格报告正是拜西班牙官方所赐,所以鉴于其开具不合格报告数量的持续增多,强烈建议正在做或者打算做西班牙注册的中国药企要提高警惕,看下西班牙官方的不合格报告中提出的问题,在自己企业是否存在,但是无论如何如果只是为了通过认证那只能应付得了眼前一时,却并不是长远之计,只有不断修炼内功,提高自己企业的GMP水平才是良策。而我们去年提到的给印度企业发了两份不合格报告的马耳他药监局,到目前为止今年共进行了20次审计,主要集中马耳他本国内(12次)和印度(6次),到目前为止还没有发布过不合格报告,但是从海外检查占比来看,马耳他进行的国外检查占到了他检查总数的接近一半,目前的重点是在印度企业,可见其对药企的监管也是比较严格的了。而德国官方包括各州的药监机构还是一如既往的宽厚仁慈,在这么大的检查基数上,今年一封不合格报告都没有开出来,如果你的企业是在做德国注册,那你运气好了。
图3:2019发出不符合报告的官方机构分布
从图4可以看出,2018-2019年度的15份不符合报告中只有6份是发给制剂企业的,剩下的9份发给了原料药生产企业。结合之前的数据,我们可以看到API企业是呈现增加的趋势,而制剂却呈现减少的趋势,而且今年API的不合格数量首次超过了制剂厂,也许这预示着从今年开始,EMA要加强对API厂的监管了,毕竟要想确保制剂的质量,API是源头。然后我们再关注一下这9家在2019年度收到不符合报告的API工厂,包括了3家中国工厂(NCPC华民和海正,江西东风,其中两家为无菌API工厂)和2家印度工厂,剩余的4家都是欧洲工厂(西班牙2家,英国2家),由此也可以佐证,欧盟官方在整体上是加严了对API工厂,尤其是无菌API的监管。而收到不合格报告的6家制剂工厂中有两家印度工厂,都是由英国药监局开具的,其他4家分布在奥地利,意大利,西班牙和丹麦,均由其自己国家开具,也许这提示欧盟官方的监管力度目前更多的放到了自己辖区内了,也可能是欧美官方互认后和美国官方交流提升的结果。
图4:2019年收到不符合报告的工厂类型分布
图5是欧盟官方检查日期和不符合报告发布的时间分布图,可以看出,在2018年上半年之前,检查之后公布不符合报告的时间间隔已经有越来越短的趋势。但是从下半年开始直到2019年上半年,出现了明显的延迟,这段时间也正是EMA启动搬迁的阶段,经过了差不多1年的动荡期,受此影响,奥地利官方的检查从检查结束到发布报告竟然用了8个多月,而今年下半年往后已经逐渐回归正常的间隔,其中丹麦发出的不合格报告从检查结束到发布已经仅仅用了3周时间,估计2020年EMA的检查会逐渐密集起来,来弥补这一年的耽搁。
图5:欧盟官方检查日期和不符合报告日期分布图
由于欧盟发布的不符合报告并没有像FDA警告信一样明确列出缺陷条数及内容,有的报告中只有条数,而没有具体每条内容,或者只列出缺陷的主题,而没有具体条数,所以本文的缺陷分类中的“条”数并不代表实际具体缺陷“个”数,仅仅是根据报告列出的中的关键和主要缺陷个数或者主题个数进行粗略分析得到,所以用“条”字和 “个”以示区分,如有不妥之处,还望大家海涵。
2018-2019年度的15封不符合报告中关键缺陷和主要缺陷以及数据完整性缺陷共计113条,我们只对其中列出了具体缺陷内容的54条缺陷进行汇总和分析,从图6和图7可以看出,和往年一样QA系统还是缺陷项最多部分,而生产系统和包装标签方面的缺陷有明显增加,QC系统、物料系统以及数据完整性的缺陷和往年持平。整体来看,生产和QA系统的缺陷数量相当。
生产控制方面,也许是沙坦事件的延伸,在设备清洗导致交叉污染风险方面的缺陷明显增多,所有交叉污染方面的缺陷都作为关键缺陷项列出,这与FDA的关注点不谋而合,而且华海和天宇都因为交叉污染的风险而被欧盟紧急检查,但是从这一事件我们可以看出欧盟官方对这类突发事件的处理态度和方法是简单而粗暴的,而且一直到现在,这件事情还发酵到欧盟要求所有生产企业对出口欧盟的产品进行评估并提交评估报告的要求,甚至还贴心的发布了评估报告的模板。另一个例子是从2018年开始在中国爆发的非洲猪瘟病毒,老百姓们关注的是今年猪肉价格的一路飞涨,而欧盟今官方却已经关注到了肝素钠以及所有使用猪提取物制品来源的API(胆红素等)进行猪瘟病毒监测的要求,在猪肉涨价,猪瘟横行的今天的中国制药行业是否会发生类似2008年肝素钠药害事件,还有待我们高度关注和重视。而无菌生产方面,设备及部件的灭菌,灭菌过程的温度和蒸汽的监控和检测,灭菌工艺的验证,模拟灌装,环境监测以及生产操作本身这些高风险的点仍然是欧盟官方检查的重点,在此提醒国内正在做或者打算做无菌产品欧美注册的厂家,如果上面提到的这些点你不真正熟悉欧美的相关指南的要求,就证明你并不是真正了解无菌生产工艺,建议还是不要被人忽悠了冒然就出手。
QA体系方面数据完整性问题,偏差和OOS的调查不彻底和无效CAPA的问题也占了很大的比重,这2个方面欧盟官方和FDA一样,也是非常关注的。建议大家保持对于QC数据完整性重视的情况下,也不能放松对于偏差和OOS的管理,尤其要提醒下稳定性研究方面的OOS数据的调查,也是会列为主要缺陷的,在调查方面要特别需要注意调查的科学性和合理性,以及CAPA的有效性。而在QC方面,方法验证不充分,记录的追溯性,OOS结果的报告,记录的受控等等老生常谈的内容仍然是检查的重点,也还是会被作为主要缺陷提出来。
图6:欧盟检查缺陷项目分布图
图7:欧盟检查缺陷项目分布比
(二)、2015.1-2019.11欧盟检查中国企业汇总分析(仅分析EudraGMDP公开的检查数据)
基于自然年的已经公开的数据,我们汇总了过去五年的数据,当然2019年目前可以获得的数据截止日期是2019年11月24日(少一个月的数据)。从图8可以看出2019年的现场检查次数和2018年比也是明显减少了接近50%,即便考虑时间因素,2019年的现场检查次数也很难回到2015-2016年的检查次数水平,这个也暗示着2019年是欧盟监管明显宽松的一年。英国脱欧如果在2020年继续不能明朗的话,那么可以预期2020年欧盟的检查也将是维持在2019年的水平,检查次数相对来说处于宽松的水平。
但是我们也从图9中看到,就不合格设施占当年的欧盟官方检查次数来说,实际2015年是欧盟现场检查在中国最为严格的一年,而从2016年到2019年,检查严格的趋势是逐步提升的。也就是说虽然整体的检查次数在2019年比2018年下降了一半,但是实际检查到的企业拿到不符合信的绝对数保持不变,所以实际的不符合占比翻了一倍。这个对那些不幸被检查的企业来说绝对是噩耗,而这个结果大概率是因为欧盟官方和美国官方一样开始采用风险评估工具对一些他们认为高风险的企业加大检查频率的结果。虽然他们的检查频次少了,但是凡是出来检查的企业都不幸被他们的评估工具正确的预期了风险,的确存在较高的风险。我们可以预期2020年一样这个不符合占比趋势会稳步的上升,是否会突破前期2015年风险评估工具应用前的最高记录,那就有待观察了。
图8:欧盟官方对中国企业的检查次数
图9:欧盟官方对中国企业的检查中不符合设施占比
另外,很有意思的是,我们也从图10中看到,外资大公司在华的设施被欧盟官方检查的比例从2016年达到最高值,占比超过了20%,而后占比大幅度下降了50%原因是国内企业从2017年开始大量企业欧盟注册占比增加。但是从2017年到2019年,外资在华设施被检查的占比也是稳步上升的。大家都知道欧盟目前对设施检查的规则是持续大量出口,或是高风险的设施会被重点检查,外资在华设施被抽到检查的比例持续上升,也就更多的意味着,在华外企的现有这些设施更多的承担了出口欧盟的业务,且应该出口的产品都是高附加值高风险的产品类型,所以才会持续被欧盟官方检查。当然,就这些设施中,唯一拿到不符合信的还是2015年GSK天津设施(天津史克),从2016年至今没有其他新的外资设施被欧盟官方检查给与不符合信。这个现象也暗示着,国内的外资合资企业,尤其是那些小分子生产设施,更多的参与到跨国大企业的全球生产布局中去了,这个对行业来说一个很好的趋势。我们一样预期在未来2020年,这个占比还会继续上升。
图10:欧盟官方对中国企业的检查中外资企业设施占比
二、美国FDA GMP检查数据汇总分析
(一)、2009-2017年FDA检查中国企业结果汇总分析(只统计CVM和CDER的检查)
图11中我们汇总了FDA对中国国内制药企业的检查次数,统计数据显示FDA对中国的检查在经历了2016年的高峰期后,从2017年开始往后的这三年一直在逐渐降低,无论是兽药部门CVM还是人用药部门CDER的检查次数来看,到今年一直是维持在一个比较稳定的状态,截至2019年11月底,FDA官方公布的检查次数为106次,基本与前两年持平。
图11. FDA在国内GMP检查的次数
而从全球的汇总数据(表3)来看,在FDA在全球的检查次数继续呈下降趋势,海外工厂的GMP检查次数呈现增长的趋势的背景下,FDA对中国检查次数和比例,却在持续降低,同时结合后面对FDA的检查结果汇总分析结果来看,这也印证了海螺研习社去年的判断,即总体来说从2018年开始FDA对于中国企业的监控是处于宽松的状态,反而对印度以及其他主要国家的海外制药企业来说却是持续加严的监管状态,这对于国内正在作美国注册的企业来讲,短期来看是件好事,因为能够比较轻松的尽快的拿到FDA的批文的可能性大大增大了,但是长远来看,如果因为已经获得了批准就沾沾自喜,认为自己GMP水平以及很高了,从而放松了对自己的要求,那等到FDA将矛头转过来的时候,就是连本带利还账之时。
表3. FDA在全球和非美国GMP检测的次数和占比统计
为了进一步分析FDA对于中国制药企业的监管情况,我们汇总分析了从2009年起至目前已经发布的2019年的检查结果中,中国内制药企业的检查结果的数量(NAI, VAI, OAI)以及比例,见图12和图13, 从该图中我们可以看到2018年和2019年的OVI (Official Action Indicated)比例都在10%, OVI的比例同样也是10%,但是在扣除了OTC生产企业(包括一些日用品,化妆品等)后,最近五年内制药企业所占的比例实际上分别为:2015年10.22%,2016年7.69%,2017年12.78%,2018年5.00%,2019年5.05%,我们可以得出的结论,即在中国FDA从2018年作为转折点,FDA开始已经放松了对中国药企的监管,转而对过去一直不够重视的OTC药品加严了监管(这个据说也是按照FDA最新的风险评估工具评估的策略,OTC目前是属于高风险的产品类别,实际看来的确如此!),至于这个阶段会持续几年?我们拭目以待。
图12. FDA在国内GMP检查的结果分类
图13. FDA在国内GMP检查的结果占比
今年我们延续过去的传统,继续跟踪了中国主要的出口制药企业收到警告信后的整改和复查情况,并且在去年的基础上更新了下面的表4。从下面的汇总表中可以看到FDA对大多数的中国非无菌制药企业的检查周期在2-3年,但是对于无菌产品,检查周期一般在1-2年;而从检查结果来看,一旦得到OVI的结果,要想在下次的检查中扭转,整改时间在1年-2年是个比较保险的时间间隔。从表4我们也可以看出,目前国内通过FDA最多的企业集团是齐鲁集团,按照目前FDA对印度企业的监管力度和方式来说,这类集团企业很有可能成为下一次趋严检查过程中的首要攻击目标。而且大家如果仔细看,可以发现FDA密集检查的企业大多都是无菌设施或是有大量制剂产品出口美国的设施,基本上FDA都做到了每年必查的频率。这些设施也是下个阶段FDA检查中重点的目标,也可能成为最早沦陷的设施。
表4中国主要企业GMP检查情况
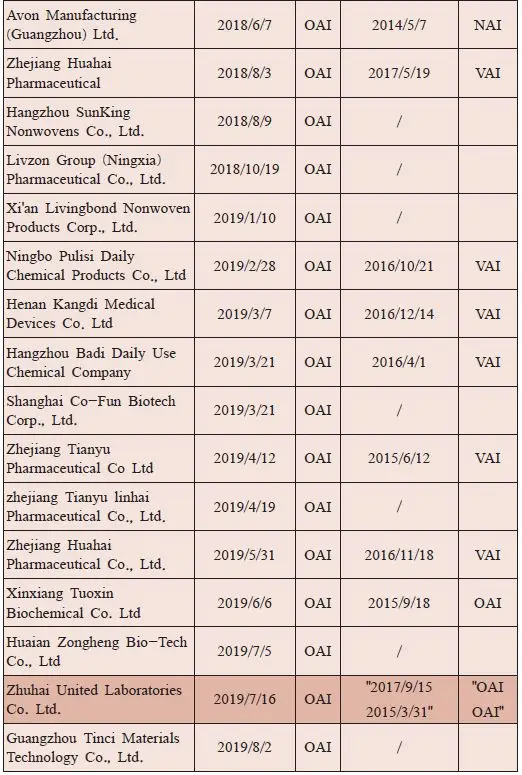
表5我们汇总了2018-2019年拿到FDA OAI检查结果的企业清单,2019年到11月25日我们统计数据为止,FDA公布的中国企业有12个设施拿到了OAI,其中OTC/化妆品企业有6个,占比50%,这些企业大概率不会在后期再投入进行整改了。和缬沙坦风暴相关的设施有3个,占比25%,天宇和华海分别已经以为OAI和FDA官方现场开了会议,他们肯定会继续加大GMP整改投入来避免警告信和确保下次检查能顺利通过。珠海联邦是个悲剧,连续2015,2017,2019三次检查都是OAI,内部的管理和对FDA整改要求的不明朗,可能是反复要求检查反复失败的本质原因。我们也再次强调,如果国内企业拿了OAI/警告信,完全可以借这个机会好好清理下历史遗留问题,内部做一个2-3年的整改计划,而不是做一个1年的整改计划。因为这个时候欲速则不达,而且给自己和官方都加大了很大压力!加之目前FDA的风险管理工具是对曾经OAI的企业即便后续检查通过了,也会加大现场检查的频率,这样的大背景下,第一次拿了OAI后,彻底整改2-3年,理清历史遗留问题,培训好团队,实际可能是经济最优的选项。类似珠海联邦这样六年三次检查都是OAI,不知道在国际上哪个客户还愿意和他们合作!而且欧美现在共享检查报告和结论,这样的OAI如果让欧盟官方看到,在下次的现场欧盟检查的时候,欧盟官方检察员的压力会有多大啊?得不偿失啊!(实际也没有得到啊!)
表5 2018-2019年FDA检查OAI企业清单
就检查时间而言(参考
图14),之前我们总结过2017年,除了传统春节假期的2月和FDA财年开始的11月,其他月份的检查数量有越来越平均分布的趋势,呈现了以7月为最高峰,往两侧逐渐减少的正态分布。检查高峰期也因此从原来的3-6月,扩大到3-10月,检查最高峰出现在7月,有24次检查。但是从2018年开始,这个趋势却发生了变化,检查呈现了两个高峰期,在2018年,第一个高峰期是在3月,有21次检查,之后一直到6月呈现降低的趋势,然后从7月又开始上升到达第二个高峰期8月,8月为全年的最高峰,有35次检查,8月之后就又开始降低,一直到12月,都不到10次检查。但是过完元旦后,就在大家开始准备春节假期的时候,FDA却猝不及防在2019年的1月安排了24次检查,这一点跟2016年非常像,而1月之后的趋势与2018年类似,也是呈现两个高峰期,第一个为3月(24次)和7月(18次),所以纵观2019年的检查,一共出现了3个高峰(1月,3月和7月),最低点出现在2月(3)和5月(7次),而除了这几个月份之外,虽然也有小的起伏,但是分布都还比较均匀。
图14. FDA在国内GMP检查的月份汇总分析
大家可以对比图15中的FDA在国内检查的设施分布图,明显增加检查次数的省份还是传统的医药制造大省浙江(增加30次检查,占比全年新增设施检查次数的23.4%)、江苏(增加22次检查,占比17.2%)、山东(增加18次检查,占比14.1%)、广东(增加12次检查,占比9.4%)、上海(增加8次检查,占比6.25%)。对于传统的制药基地比如河北(增加5次检查); 重庆(增加1次检查);四川(增加1次检查);辽宁(没有增加检查)呈现了明显的检查次数降低的趋势,这个原因更多的是环保安全的整改,让这些传统大宗原料药生产基地的生产受到了明显的影响,同时这些区域的设施产品都是大宗兽药为主,而FDA的监管风险重点是OTC产品、无菌制剂产品以及高附加值的新原料药产品的PAI检查。就这个趋势来说,这些真的传统的制造基地在未来2020年还将继续这个趋势,产业会持续转移出来,检查次数也会持续降低。
图15. FDA在国内GMP检查的结果分类(2009-2019)
(二)、2019年FDA警告信汇总分析
92封警告信分别发给了13个不同国家和地区的工厂,虽然数量上比2018年少,但是从国家分布来看,除了美中印韩和加拿大这五国仍然保留之外,很多前面没有收到过警告信的国家在今年都收到了警告信,比如新加坡、巴哈马、哥斯达黎加、马来西亚、韩国、西班牙和土耳其,可见FDA在安排检查时也在有意的去检查一些在过去检查频率低的地区和企业,尤其是我们后面分析到的一些OTC生产企业。
图16为对这92封警告信按照国家分类,从结果可以看到,排名前四的国家依然为美国、中国、印度和韩国,共得到82封警告信,占到了全部警告信的89%,无论从数量还是比例上都增加明显,而从拿到警告信的国家地域来看,从2018年开始,FDA的检查除了美中印韩四国之外在全球范围内进一步扩大,鉴于美中印韩四国收到的警告信数量最多,在后续的分析中,我们只针对美中印韩四国的检查情况进行分析。
图16.最近三年收到警告信工厂的国家和地区分布
针对美中印韩四国的检查情况,海螺研习社根据检查时间汇总了2017,2018和2019三年中每年接受的检查以及最终收到警告信的数量和比例,见表6,并逐一分析了这四个国家工厂收到警告信的情况,具体分析如下:
一直以来,中国工厂拿到警告信的比例和欧美发达国家以及印度相比还是偏高的。如表21中总结的,尤其是2017年进行的检查中,最终拿到警告信的比例竟然有接近十分之一,而在2018年有了一些好转,但是2019年截至目前进行了的检查中,已经有5.66%的企业拿到了警告信,到明年年底再更新2019年的数据时,预计这个比例会增高很多,因为毕竟到现在已经拿到警告信的都是在今年上半年进行的审计。中国企业警告信比例如此高的原因正如去年我们所分析的,FDA在最近几年加大了对OTC药企的监管力度,回顾最近三年的检查,收到警告信的中国企业中有一半是OTC生产企业,另外FDA今年也继续延续了这个重点,截止目前进行的检查中收到警告信的7家企业中除了1家API,1家合同检测机构外,另外5家全部是OTC药品生产商。原因也如去年所述,这些OTC生产企业公司基本都是没有欧美GMP管理经验的化妆品、日用品和科技公司,很多不明白FDA对于OTC产品的分类和GMP要求,或者就是被贸易商忽悠而进入了美国市场,在FDA加大了对这些生产企业的监管和检查力度后,得到警告信也是很正常的一件事。从FDA对这些企业的检查结果来看,这些企业确实存在非常大的问题,今年11月FDA刚刚发给Greenbrier International (Dollar Tree Store美元树商店的总部,拥有将近16000家一美元商店,是美国一家经营折扣廉价杂货的连锁店,主要提供糖果、食物、保健品、美容产品、日常消费品、纸类、化学品和冷冻冷藏食品等)一封警告信,信中提到FDA检查了其分销仓库和一些合同生产商,发现了严重违背cGMP的缺陷,信中提到了三家已被列入进口禁令的中国日用品生产工厂 :上海维尔雅,杭州中波,宁波普利斯,相信后面会有更多的中国日用化工企业因此受到检查,这里我们也提醒国内这些日用化工企业,FDA对中国OTC生产企业的检查肯定还没有结束,如果希望贸易做的长久,多多了解美国FDA的要求,修炼内功才是长远之计。收到合同实验室的警告信的是上海医工院,原因是他们拒绝了FDA的检查。
美国工厂虽然拿到的警告信数量多,但是那是因为FDA的检查总数量多,从比例上看美国是拿警告信最多的前10个国家中最低的,说明美国制药企业的整体GMP管理水平还是不错的。但是从最近三年的发布警告信的比例来看,FDA在2018年进行的检查中最终拿到警告信的比例是最高的,从检查的企业类型来看,最近三年拿到警告信的企业也有一半是OTC生产企业,这一点也可以印证OTC生产企业是FDA最近几年的关注重点之一。
印度工厂,从表21中可以明显看到,去年收到警告信的数量和比例有所下降之后,今年又有明显上升。在收到警告信的13家工厂中有5家原料药生产企业,8家制剂生产企业,并没有OTC企业,而且拿到警告信的工厂中不乏印度比较大的制药企业,比如Aurobindo, Strides, Indoco, Mylan, Lupin等,可见FDA对于印度企业的监管还是集中在对这些高风险的大型制药企业的常规定期检查上,其实前面几年FDA对印度这些大型药企每年的检查次数并不少,但是今年的检查结果却是有些惨,尤其是Aurobindo今年检查了6个场地,其中有3个是OVI的结果,到目前为止有1个场地(Unit XI)拿到了警告信,缺陷中还强调了在这个场地中发现的缺陷,在整个集团公司内其他设施检查时也有发现同样类型的缺陷重复出现,并且特别提到了两外两个拿到了OVI的场地,这也是FDA加大了对其集团内其他场地的检查力度原因。而从缺陷内容来看,CAPA无效的缺陷占据了比较大的比重。
4. 韩国企业今年仍然占据了第四位,汇总这三年韩国收到的共12封警告信中,OTC企业有7家,占到了一半多,究其原因其实也跟中国企业一样,韩国出口到美国的产品中有相当数量的OTC药品,在FDA加大了对OTC药品的监管后,警告信数量的增加也是理所当然的了。
表6:美中印韩四国检查数量和警告信比例
备注:
1. 只统计CDER进行的GMP检查。
2. 没有统计美国药房制剂(Compounding)公司的检查数据。
3. 警告信比例为当年进行的检查中收到的警告信数量除以检查数量的比例。
4. 由于警告信发布的延时性,2019年的警告信比例仅供参考。
从图17中我们可以看到,92家收到警告信的企业中,有12家是API生产企业和79家制剂生产企业,制剂企业的比例从2017年的69.3%扩大到2018年的75.3%之后,在2019年再创新高,达到了85.9%。这79家制剂生产企业中,有38家为OTC生产企业,12家为无菌制剂生产企业,分别占比48.1%和15.2%。今年的情况也印证了去年海螺研习社的猜测,FDA的风控体系中把OTC和无菌产品列为了高风险,从而加大了对这类企业的监管,这也是中国在2019年API收到警告信数量减少的原因。这也给我们国内计划进行制剂申报尤其是无菌制剂申报的企业提了一个醒,需要关注自己企业的GMP状态,保持持续迎检的状态。
图17收到警告信的工厂类型分布
图18显示了API工厂收到警告信的国家分布情况,2017年收到警告信的18家API企业,中国和印度各9家,可谓平分秋色,而在2018年度,收到警告信API企业明显呈现分散的趋势,19封警告信发布给了8个国家,遍布北美、欧洲和亚洲。而2019年收到警告信的国家则只集中分布在印度,美国和中国,其中印度API企业收到的警告信数量最多,具体数据请看图18。这个对于目前国内不少制剂企业计划从印度进口API用于一致性评价项目而言,绝对是一个打击。如何对印度供应商进行有效的监管和评价,并且把控其质量风险,也成为国内制剂企业的一个新的挑战。相信国家局会参考FDA对印度API企业的检查结果来调整自己的现场检查对象和目标,同时也会加强对印度来源的API的监管。我们拭目以待多少国内的制剂企业受到不合规印度API企业的冲击。
图18. API工厂警告信国家分布
在图19中我们持续汇总分析了检查时间和警告信发布时间之间的间隔。今年以来FDA发布警告信的间隔基本上稳定性在6个月左右,并没有再明显缩短,而且从汇总结果来看,年初的FDA停摆,也并没有影响FDA这部分工作的效率,另外一个值得我们关注的情况是如FDA已经在GDUFA II中所承诺的,从2018年10月1日开始,会在所有检查完成后的90天内通知检查结果的状态(OAI, VAI或NAI),截止11月底,FDA发布的检查结果分级最新已经更新到了11月6日,可见其检查结果分级的公布效率有了大大的提高。
图19. FDA检查时间和警告信发布时间图
2019年的92封警告信中共有292条缺陷,主要分布请见图20。其中QA系统缺陷97项,QC系统缺陷94项,生产方面缺陷有70项,设备方面缺陷21项,标签包装方面缺陷1条,物料系统缺陷11条,对比2017年和2018年的情况,可以看到QA系统的缺陷有了明显减少,而生产系统的缺陷明显增加,其他方面缺陷基本与前面持平,QA系统的缺陷集中在调查不彻底方面,占到了QA缺陷的四分之一,另外有四分之一的工厂都有稳定性方面的缺陷,主要体现在工厂没有相应的稳定性研究方案,稳定性数据并不能支持产品有效期两个方面,而生产方面的缺陷今年有了一个非常明显的增长,究其原因恐怕与华海缬沙坦事件脱不了干系,自从缬沙坦事件后,FDA特别关注生产过程中的交叉污染风险,清洗验证和清洗操作,从而导致今年的生产缺陷非常增多,但是就最近FDA和欧美发布的最新消息来看,FDA已经把关注方向又转移到了回收溶剂以及溶剂加工企业,所以我们预计明年FDA也许会重点查看生产过程中的溶剂的使用,在国内目前环保抓的这么严的形势下,国内企业的溶媒的使用和回收,回收工艺的研究,使用回收溶剂的产品的杂质研究都要重点关注和研究了,不要以为一句我们只使用新鲜溶剂就可以万事大吉了。另外92封警告信中涉及数据完整性的有17封,与去年的水平持平,可见数据完整性现在FDA已经把数据完整性的检查列为了常规内容,而且从最近发布的483中我们看出除了实验室的数据完整性之外,随着目前生产设备的自动化进一步提高,FDA也已经开始关注生产设备和公用系统的数据完整性了。
图20. FDA警告信中质量体系缺陷项目分布图
结束语:2019年已经即将过去,CGMP的路上我们度过了一个监管相对宽松的一年,在未来2020年,我们整体预期还将是欧美监管宽松的一年。当然,我们会关注美国国会今年听证会的后续是否有采取什么措施,是否会给FDA更大的压力来监管中国制药企业。对于大的趋势而言,我们相信美国国会会要求FDA更加严格的监管海外的设施,会要求FDA加大中国办公室检查人员的检查能力,而这些具体的措施产生效果估计会在2021年下半年,而数据反馈和业界人员的感受会到2022年才会感知。让我们抓紧现在的宽松环境做好基础的工作吧,要知道风暴来的时候,只有那些充分准备的企业才可以生存下来。祝大家好运!
 |手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033
|手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033