欢迎您注册蒲公英
您需要 登录 才可以下载或查看,没有帐号?立即注册
x
为进一步规范和指导生物类似药说明书的撰写,并提供相关技术标准,国家药监局药审中心于2025年1月27日发布了《生物类似药说明书撰写技术指导原则》,并要求自发布之日起施行。

本文就该文件核心内容进行总结,剖析生物类似药说明书撰写的要点。 内容总结 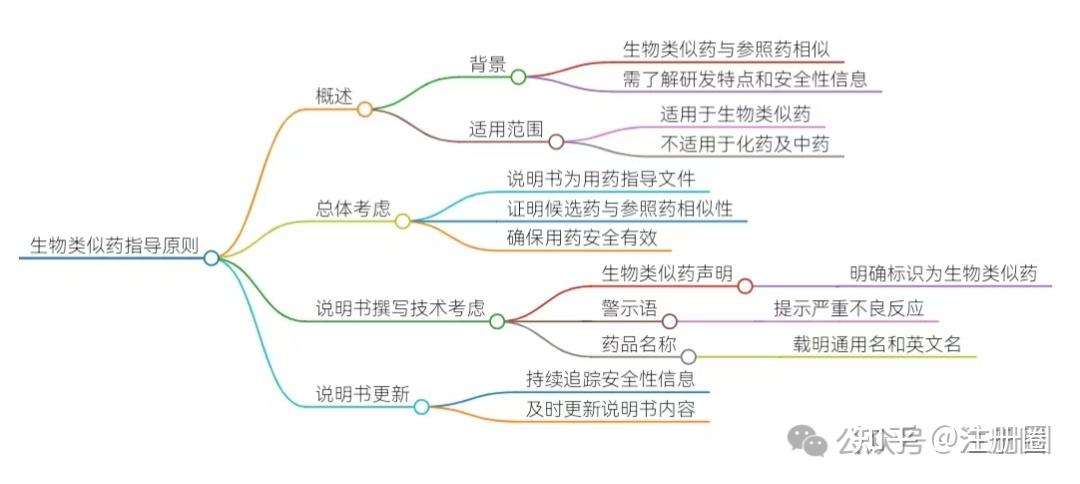 01 概述 (1)背景 ● 生物类似药是指在质量、有效性和安全性方面与已获准注册的参照药具有相似性的治疗用生物制品。 ● 该指导原则的制定是为了帮助临床医生和患者了解生物类似药的研发特点及其安全有效性信息,以便合理用药。 ● 本指导原则不具法律约束力,随着科学研究的进展将不断更新。 (2)适用范围 ● 本指导原则适用于生物类似药,不适用于化药、其他生物制品及中药。 02 总体考虑 ● 药品说明书是指导医生和患者合理用药的重要文件,必须包括有效性和安全性的主要科学信息。 ● 生物类似药的研发目标是证明候选药与参照药之间的相似性,而非独立地证实其有效性和安全性。 ● 建议在说明书中纳入参照药的相关信息,以确保用药安全和有效。 03 说明书撰写的技术考虑 (1)生物类似药声明 ● 在说明书中应明确标识该产品为生物类似药,并在首页显著位置添加声明。 (2)警示语 ● 对药品严重不良反应及潜在安全性问题加以警示,提醒用药人群注意安全性事项。 (3)药品名称 ● 说明书中需载明批准的通用名、英文名称及商品名,以便追溯药物警戒信息。 (4)成分、性状、规格 ● 需客观、准确描述生物类似药的成分、性状和规格,与批准的质量标准一致。 (5)适应症和用法用量 ● 应基于生物类似药申请的情况及研究情况制定,确保与参照药说明书的表述一致。 (6)不良反应与注意事项等安全性信息 ● 安全性信息应与参照药在相同使用条件下的安全性信息表述一致。 (7)禁忌 ● 需关注是否需要增加对生物类似药产品中成分过敏患者的禁忌。 (8)特殊人群 ● 特殊人群用药的相关信息应依据参照药说明书制定。 (9)药物相互作用 ● 应结合生物类似药的实际特点描述。 (10)临床药理 ● 应依据参照药的说明书相关信息制定。 (11)临床试验 ● 内容应基于生物类似药批准的适应症,简要描述关键临床试验信息。 (12)药理毒理 ● 根据参照药的说明书信息制定。 (13)贮藏、包装 ● 描述应与批准的质量标准一致。 (14)有效期、药品上市许可持有人、生产企业 ● 参照相关指导原则撰写。 04 生物类似药说明书更新 ● 上市许可持有人需负责生物类似药说明书的全生命周期管理,持续追踪、收集安全性信息,并及时更新说明书。 要点剖析 01 什么是生物类似药? 生物类似药是指在质量、有效性、安全性三方面与已上市的参照药(原研生物药)高度相似的治疗用生物制品。与化学仿制药不同,生物类似药需通过严格的比对试验证明其与参照药“无临床意义的差异”,而非完全独立验证疗效和安全性。 关键提示:说明书需明确标注“生物类似药”身份,并在首页注明与参照药的关联性,避免混淆。 02 说明书撰写的核心原则 (1)突出生物类似药特性 ● 声明标识:在说明书首页显著位置标注“本品为XX参照药的生物类似药”,并附上生物类似药定义。 ● 商品名与通用名规范: - 生物类似药商品名仅用于描述自身特性(如适应症、规格)。
- 参照药商品名用于引用其临床试验数据。
- 通用名适用于两者共有的风险描述(如不良反应)。
(2)安全性信息需精准溯源 ● 不良反应与警示语:基于参照药数据,但需明确标注来源。例如:“本节不良反应描述基于参照药的临床证据”。 ● 免疫原性声明:需注明检测方法差异可能导致抗体发生率不可比,避免误导。 ● 可追溯性要求:在注意事项中强调记录药品商品名、批号等信息,便于追踪安全性问题。 (3)适应症与用法用量的“一致性” ● 生物类似药的适应症范围不可超过参照药已批准的范围。若获批适应症少于参照药,说明书中需剔除未批准内容。 ● 若参照药的安全性信息为汇总数据且难以拆分,可沿用整体数据,但需隐藏未获批的适应症描述。 03 特殊人群与更新管理 ● 特殊人群用药(孕妇、儿童、老年人):直接引用参照药数据,并用商品名标注来源。 ● 说明书动态更新:上市许可持有人需持续追踪生物类似药和参照药的安全性信息,及时更新说明书,确保内容准确。 04 给行业的建议 ● 科学严谨:说明书内容需基于比对试验数据,避免夸大或模糊表述。 ● 清晰透明:通过规范命名和标识,帮助医生与患者快速区分生物类似药与参照药。 ● 全生命周期管理:从研发到上市后监测,说明书需动态反映最新科学证据。 结语 生物类似药的普及为患者提供了更多治疗选择,但其说明书的科学性与规范性直接影响用药安全。遵循指导原则,强化信息透明与动态管理,才能让生物类似药真正“类似”且“可靠”。
声明:本文转载来源于公众号【注册圈】,文章版权归原作者所有,如若了解更多信息可自行前往查看。违规请版主删除。 更多资料请前往注册圈网站 注册圈 杭州几度数据技术有限公司
|  |手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033
|手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033